��Ŀ����
16����ҵ������ʱ�����ô�������Ӧ��SO2ת��ΪSO3��һ���ؼ��IJ��裮
��1��һ�������£�SO2�ɷ�����Ӧ��SO2��g��+$\frac{1}{2}$O2��g��?SO3��g����H=-98kJ•mol-1��
��ij�¶��£���100L�ĺ����ܱ������п�ʼ����4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=$\frac{10}{3}$���÷�����ʾ����
��������Ӧ������ͬ�����ʵ���Ͷ�ϣ����SO2�ڲ�ͬ�¶��µ�ƽ��ת����a%��ѹǿ�Ĺ�ϵ��ͼ1��ʾ������˵����ȷ����ABCD������ţ���
A���¶ȣ�T3��T2��T1
B������Ӧ���ʣ�v��c����v��a����v��b����v��d��
C��ƽ�ⳣ����K��a����k��c����K��b��=K��d��
D��ƽ��Ħ��������M��a����M��c����M��b����M��d��
��������Ӧ��ƽ������¶Ⱥ�������ѹǿ���䣬����ͨ��һ����SO3��g������SO2������������䣨���������С���������䡱����
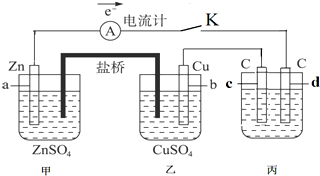
��2��ij����������ͼ2��ʾװ���õ绯ѧԭ��ģ���������
��ͨ��O2�ĵ缫��������
��д��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��SO2-2e-+2H2O=SO42-+4H+
�����˹�����ת����0.2mol���ӣ�������Ĥ������Һ�������仯���m��-��m�ң�Ϊ4.4g������������ܽ⣩��
���� ��1����ƽ��ʱ�ų�����Ϊ196kJ�������ĵĶ�������Ϊ$\frac{196kJ}{93kJ/mol}$=2mol����
SO2��g��+$\frac{1}{2}$O2��g��?SO3��g��
��ʼ����mol����4 10 0
�仯����mol����2 1 2
ƽ������mol����2 9 2
�ٸ���K=$\frac{c��S{O}_{3}��}{c��S{O}_{3}����\sqrt{c��{O}_{2}��}}$����ƽ�ⳣ����
��A���÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ�SO2��ת����Խ��
B����ͼ��֪��a��c����ѹǿ��ͬ��ƽ��ʱa��SO2ת���ʸ��ߣ��÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ�SO2��ת����Խ���¶�T1��T3���¶�Խ�ߣ���Ӧ����Խ�죻b��d�����¶���ͬ��ѹǿԽ�ߣ���Ӧ����Խ��
C����ͼ��֪��a��c����ѹǿ��ͬ��ƽ��ʱa��SO2ת���ʸ��ߣ��÷�ӦΪ���ȷ�Ӧ�����¶�T1��T3�������¶�ƽ��������Ӧ�����ƶ���Kֵ����ƽ�ⳣ��ֻ���¶��йأ�b��d�����¶���ͬ��ƽ�ⳣ����ͬ��
D��SO2ת���ʵ�Խ��n��ԽС�����M=$\frac{m}{n}$�жϣ�
�������¶Ȳ��䣬��Kֵ���䣬������ѹǿ���䣬������巴Ӧƽ�ⲻ�ƶ�����ʹ��ͨ��һ����SO3��g����SO2���������Ҳ���䣻
��2��������������ԭ��Ӧ��ͨ��O2�ĵ缫��������
��SO2����������Ӧ��ʧȥ���ӣ�������������ӣ��ɵ���غ��֪�����������ɣ�
���������IJ���������ͨ�����ӽ���Ĥ�����Ҳ࣬�Ҳ�������õ��ӣ���������������ˮ�����˹�����ת����0.2mol���ӣ���ͨ�����ӽ���Ĥ��������Ϊ0.2mol�����ݵ���ת���غ���㷴Ӧ�Ķ�����������������������Ĥ������Һ�������仯���m��-��m��=m��SO2��-m��H+��-[m��O2��+m��H+��]��
��� �⣺��1����ƽ��ʱ�ų�����Ϊ196kJ�������ĵĶ�������Ϊ$\frac{196kJ}{93kJ/mol}$=2mol����
SO2��g��+$\frac{1}{2}$O2��g��?SO3��g��
��ʼ����mol����4 10 0
�仯����mol����2 1 2
ƽ������mol����2 9 2
ƽ�ⳣ��K=$\frac{c��S{O}_{3}��}{c��S{O}_{3}����\sqrt{c��{O}_{2}��}}$=$\frac{\frac{2}{100}}{\frac{2}{100}��\sqrt{\frac{9}{100}}}$=$\frac{10}{3}$���ʴ�Ϊ��$\frac{10}{3}$��
��A���÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ�SO2��ת����Խ���¶ȣ�T3��T2��T1����A��ȷ��
B����ͼ��֪��a��c����ѹǿ��ͬ��ƽ��ʱa��SO2ת���ʸ��ߣ��÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ�SO2��ת����Խ���¶�T1��T3���¶�Խ�ߣ���Ӧ����Խ�죬��v��c����v��a����b��d�����¶���ͬ��ѹǿԽ�ߣ���Ӧ����Խ��Ӧ��Ӧ���ʣ�v��b����v��d������B��ȷ��
C����ͼ��֪��a��c����ѹǿ��ͬ��ƽ��ʱa��SO2ת���ʸ��ߣ��÷�ӦΪ���ȷ�Ӧ�����¶�T1��T3�������¶�ƽ��������Ӧ�����ƶ���Kֵ������ƽ�ⳣ����K��a����k��c����ƽ�ⳣ��ֻ���¶��йأ�b��d�����¶���ͬ��ƽ�ⳣ����ͬ����K��b��=K��d������C��ȷ��
D��SO2ת���ʵ�Խ��n��ԽС������������������䣬��M=$\frac{m}{n}$��֪ƽ��Ħ��������M��a����M��c����M��b����M��d������D��ȷ��
��ѡ��ABCD��
�������¶Ȳ��䣬��Kֵ���䣬������ѹǿ���䣬������巴Ӧƽ�ⲻ�ƶ�����ʹ��ͨ��һ����SO3��g����SO2���������Ҳ���䣬�ʴ�Ϊ�����䣻
��2��������������ԭ��Ӧ��ͨ��O2�ĵ缫���������ʴ�Ϊ������
��SO2����������Ӧ��ʧȥ���ӣ�������������ӣ��ɵ���غ��֪�����������ɣ��缫��ӦʽΪ��SO2-2e-+2H2O=SO42-+4H+��
�ʴ�Ϊ��SO2-2e-+2H2O=SO42-+4H+��
���������IJ���������ͨ�����ӽ���Ĥ�����Ҳ࣬�Ҳ�������õ��ӣ���������������ˮ�����˹�����ת����0.2mol���ӣ���ͨ�����ӽ���Ĥ��������Ϊ0.2mol�����ݵ���ת���غ㣬��Ӧ�Ķ�������Ϊ$\frac{0.2mol}{2}$=0.1mol������Ϊ0.1mol��64g/mol=6.4g����Ӧ������Ϊ$\frac{0.2mol}{4}$=0.05mol����������Ϊ0.05mol��32g/mol=1.6g��������Ĥ������Һ�������仯���m��-��m��=m��SO2��-m��H+��-[m��O2��+m��H+��]=6.4g-1.6g-2��0.2mol��1g/mol=4.4g��
�ʴ�Ϊ��4.4g��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ����ԭ���ԭ�������㣬��2���м���Ϊ�״��㡢�ѵ㣬ѧ�����������ӵ��ƶ����ѶȽϴ�

 ��У����ϵ�д�
��У����ϵ�д���1����1.0mol CH4��2.0mol H2O��g��ͨ�뷴Ӧ�ң��ݻ�Ϊ100L������һ�������·�����Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g����I��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����Ϊ0.003 mol•L-1•min-1��
��ͼ�е�P1��P2�����������������=������100��ʱƽ�ⳣ��Ϊ2.25��10-4��
����������������ʱ�����¶ȣ��淴Ӧ���ʽ���С���������С�����䡱����
��2��ѹǿΪ0.1MPa�����£�a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g������
�ܸ÷�Ӧ�ġ�H��0����S��0�����������������=������
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���BD��
A�������¶� B����CH3OH��g������ϵ�з������C������He��ʹ��ϵ��ѹǿ���� D���ٳ���l mol CO��3mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��У�
| ʵ���� | T���棩 | n����C��/n | P��MPa�� |
| �� | 150 | $\frac{1}{3}$ | 0.1 |
| �� | 150 | $\frac{1}{3}$ | 5 |
| �� | 350 | $\frac{1}{3}$ | 5 |
B�����ݷ�Ӧ����ص㣬�ڸ���������ͼ�У���������0.1MPa��5MPa������CO��ת�������¶ȱ仯����������ʾ��ͼ2���������������ߵ�ѹǿ��

| A�� | AlCl3 | B�� | CuCl2 | C�� | FeCl2 | D�� | HCl |

 ClO2��Ϊ�����������������ж��������������й㷺��Ӧ��ǰ����ijͬѧ����ͼ��ʾ��װ���Ʊ�ClO2���壬��Ӧԭ��Ϊ���Ͳ�����Һ��KClO3��ĩ��60��ʱ��Ӧ�Ƶ�ClO2���¶ȹ�����Ͷ���Ӱ������Ч�ʣ�
ClO2��Ϊ�����������������ж��������������й㷺��Ӧ��ǰ����ijͬѧ����ͼ��ʾ��װ���Ʊ�ClO2���壬��Ӧԭ��Ϊ���Ͳ�����Һ��KClO3��ĩ��60��ʱ��Ӧ�Ƶ�ClO2���¶ȹ�����Ͷ���Ӱ������Ч�ʣ�
