题目内容
4.许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂.下列是重要的含氯漂白剂NaClO2的工业合成流程图.
已知:纯ClO2易发生爆炸.请回答下列问题:
(1)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是用pH试纸检验溶液的pH.
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是a(填代号).
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+
(4)为了测定NaClO2•3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2~3滴淀粉溶液,用0.264mol/L Na2S2O3标准液滴定,锥形瓶中溶液蓝色变为无色(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格合格(填“合格”或“不合格”,合格纯度在90%以上).提示:2Na2S2O3+I2═Na2S4O4+2NaI.
分析 根据题中流程,发生器中NaClO3在酸性条件下被还原成ClO2,在吸收塔中ClO2在碱性条件下被双氧水还原成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)检验溶液的酸碱性可用pH试纸检验;
(2)除杂不能引入新的杂质;
(3)红褐色沉淀应为Fe(OH)3沉淀,根据反应物和生成结合质量守恒定律书写化学方程式;
(4)根据反应:ClO2-+4I-+4H+=Cl-+2I2+2H2O,以及2Na2S2O3+I2═Na2S4O6+2NaI,
可得反应的关系式:ClO2-~2I2~4Na2S2O3,根据关系式计算;
解答 解:根据题中流程,发生器中NaClO3在酸性条件下被还原成ClO2,在吸收塔中ClO2在碱性条件下被双氧水还原成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)检验溶液的酸碱性最简单的方法可用PH试纸检验,
故答案为:用pH试纸检验溶液的pH;
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可用Na2O2 ,而其它还原剂都能引入新的杂质,只有a符合,
故答案为:a;
(3)红褐色沉淀应为Fe(OH)3沉淀,反应物为ClO2-和Fe2+,生成物有Fe(OH)3,根据氧化还原反应得失电子守恒和质量守恒可写出反应的化学方程式为3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+,
故答案为:3ClO2-+12Fe2++6H2O=4Fe(OH)3↓+3Cl-+8Fe3+;
(4)取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,发生ClO2-+4I-+4H+=Cl-+2I2+2H2O,充分反应后加入2~3滴淀粉溶液,溶液变蓝,用0.264mol/L Na2S2O3标准液滴定,发生:2Na2S2O3+I2═Na2S4O6+2NaI,蓝色变为无色,
可得反应的关系式为:ClO2-~2I2~4Na2S2O3,又n(Na2S2O3)=0.264mol/L×0.02L=0.00528mol,
则ClO2-~2I2~4Na2S2O3
1 4
n(ClO2-) 0.00528mol
n(ClO2-)=$\frac{0.00528mol}{4}$=0.00132mol,
所以500ml溶液中含有:n(NaClO2)=0.00132mol×50=0.066mol,
则10g合成产品中含有:m(NaClO2•3H2O)=0.066mol×144.5g/mol=9.537g,
则ω(NaClO2•3H2O)=$\frac{9.537g}{10g}$=95.37%>90%,所以产品合格,
故答案为:蓝色变为无色;合格.
点评 本题考查较为综合,涉及物质的检验、除杂、制备以及含量的测定,题目难度较大,本题(4)为易错点,注意把握有关反应方程式的书写.

| A. | H2O2的电子式: | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 乙酸分子的球棍模型: | |
| D. | 离子结构示意图 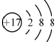 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
| A. | 此钢瓶的容积为44.8L | |
| B. | 此钢瓶的质量为15g | |
| C. | 气体X对氢气的相对密度为22 | |
| D. | 该状况下此钢瓶中盛满氯气时的总质量为142g |
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |

