题目内容
1.已知A、B、C、D、E是短周期元素,原子序数依次增大.其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的合金是日常生活中常用的金属材料.下列说法正确的是(1)E的原子结构示意图:
 ;B的最高价氧化物电子式
;B的最高价氧化物电子式
(2)C、D的最高价氧化物对应的水化物之间发生化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O
(3)化合物AE含有共价键,CE含有离子键.
分析 A、B、C、D、E是短周期元素,原子序数依次增大,元素C在同周期的主族元素中原子半径最大,则C处于IA族;元素B的原子最外层电子数是其电子层数的2倍,B原子最外层电子数为4或6,C的原子序数大于B,则C为Na元素、B为C元素;而元素A、E的单质在常温下呈气态,结合原子序数大小可推知A为H元素,E为Cl元素;元素D的合金是日常生活中常用的金属材料,可推知D为Al,据此进行解答.
解答 解:A、B、C、D、E是短周期元素,原子序数依次增大,元素C在同周期的主族元素中原子半径最大,则C处于IA族;元素B的原子最外层电子数是其电子层数的2倍,B原子最外层电子数为4或6,C的原子序数大于B,则C为Na元素、B为C元素;而元素A、E的单质在常温下呈气态,结合原子序数大小可推知A为H元素,E为Cl元素;元素D的合金是日常生活中常用的金属材料,可推知D为Al,
(1)E为Cl元素,原子序数=核外电子总数=17,最外层含有7个电子,其原子结构示意图为: ;B为C元素,其最高价氧化物为二氧化碳,二氧化碳为共价化合物,分子中含有两个碳氧双键,其电子式为
;B为C元素,其最高价氧化物为二氧化碳,二氧化碳为共价化合物,分子中含有两个碳氧双键,其电子式为 ,
,
故答案为: ;
; ;
;
(2)C、D的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者发生化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(3)混合物AE为HCl,为共价化合物,分子中含有共价键;混合物CE为NaCl,为离子化合物,含有离子键,
故答案为:共价;离子.
点评 本题考查了位置、结构与性质关系的关系及应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
11.一定条件下,可逆反应N2+3H2═2NH3(放热反应) 达到平衡后,只改变一个条件,下列叙述错误的是( )
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
12.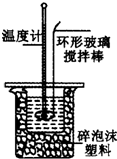 某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
I.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从如表中选择称量NaOH固体所需要的仪器是(填字母):
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(3)取50mL.NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①上表中的温度差平均值为4.0℃;
②近似认为0.50mol/L NaOH溶液和O.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H-53.5kJ/mol (取小数点后一位).
③上述实验数值结果与57.3kJ•mol叫有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.I.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体5.0g.
(2)从如表中选择称量NaOH固体所需要的仪器是(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(3)取50mL.NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和O.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H-53.5kJ/mol (取小数点后一位).
③上述实验数值结果与57.3kJ•mol叫有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
9.下列有关有机化合物的性质、结构或用途的说法正确的是( )
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 乙烯的性质与聚乙烯相同 | |
| C. | 乙醇既可以作燃料,也可以在日常生活中使用,如75%的乙醇经常用于医疗上杀菌、消毒 | |
| D. | 蛋白质溶液中分别加入(NH4)2SO4稀溶液和CuSO4溶液,均有沉淀,原理不相同 |
6.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙,若电路中转移6.02×1022个e-,则C上增加的质量为3.2g.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙,若电路中转移6.02×1022个e-,则C上增加的质量为3.2g.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活动性由强到弱的顺序是D>A>B>C.
10.2011年美国政府批准生产480亿升乙醇.在美国40%的玉米用于制造乙醇,科学研究显示利用植物秸秆及其废弃物可制成乙醇燃料.下列关于乙醇燃料的说法中错误的是( )
| A. | 乙醇是一种可再生能源 | |
| B. | 乙醇只能在实验室内做燃料 | |
| C. | 乙醇易燃烧,污染小 | |
| D. | 目前,粮食作物是制乙醇的重要原料 |
11.制取1,2-二氯丙烷最好的方法是( )
| A. | 丙烷与氯气物质的1:2反应 | B. | 丙烯与氯气反应 | ||
| C. | 丙炔与氯气反应 | D. | 丙烯与氯化氢反应 |
 和
和