题目内容
5. 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.(1)炼钢开始和结束阶段都可能发生反应:Si+2FeO$\stackrel{高温}{→}$ 2Fe+SiO2,其目的是CD.
A.得到副产品硅酸盐水泥
B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质
D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)→Si(s)+4HCl(g)△H=-0.025akJ/mol.
对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是BC
A.NaX易水解
B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4 D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅.硅烷的热稳定性弱于甲烷,所以Si元素的非金属性弱于C元素,用原子结构解释其原因:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”).
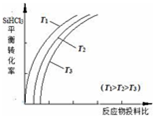
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)制得高纯硅.不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如下图所示.下列说法正确的是a、c(填字母序号).
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是$\frac{n(SiHCl3)}{n(H2)}$
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3.室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是硅酸钠,其原因是硅酸的Ki2小于碳酸的Ki2,硅酸钠更易水解.
已知:H2SiO3:Ki1=2.0×10-10 Ki2=1.0×10-12 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11.
分析 (1)根据炼钢的要求把生铁中的含碳量去除到规定范围,并使其它元素的含量减少或增加到规定范围的过程,简单地说,是对生铁降碳、去硫磷、调硅锰含量的过程;在使碳等元素降到规定范围后,钢水中仍含有大量的氧元素,是有害的杂质,使钢塑性变坏,轧制时易产生裂纹;
(2)每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,据此写出反应热化学方程式;
A.强酸的钠盐不水解;
B.硅的卤化物(SiX4)是由非金属元素原子间通过共用电子对形成的化合物;
C.离子晶体的熔点大于分子晶体的熔点;
D.SiF4晶体属于分子晶体.
(3)硅烷的分解温度远低于甲烷的原因为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(4)a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$;
c.降低压强平衡向气体系数减小方向移动;
(5)依据盐类水解规律“越弱越水解”解答.
解答 解:(1)炼钢的要求把生铁中的含碳量去除到规定范围,并使其它元素的含量减少或增加到规定范围的过程,简单地说,是对生铁降碳、去硫磷、调硅锰含量的过程,这一过程基本上是一个氧化过程,是用不同来源的氧(如空气中的氧、纯氧气、铁矿石中的氧)来氧化铁水中的碳、硅、锰等元素.化学反应主要是2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2、FeO+Mn$\frac{\underline{\;高温\;}}{\;}$ Fe+MnO;
在使碳等元素降到规定范围后,钢水中仍含有大量的氧,是有害的杂质,使钢塑性变坏,轧制时易产生裂纹,故炼钢的最后阶段必须加入脱氧剂(例如锰铁、硅铁和铝等),以除去钢液中多余的氧:Mn+FeO$\frac{\underline{\;高温\;}}{\;}$MnO+Fe,Si+2FeO$\frac{\underline{\;高温\;}}{\;}$SiO2+2Fe,Al+3FeO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe,
故选:CD;
(2)由题意可知:每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{a}{\frac{1.12×1{0}^{3}}{28}}$=0.025aKJ,所以该反应的热化学方程式:SiCl4(g)+2H2(g)→Si(s)+4HCl(g)△H=-0.025akJ/mol;
A.钠的强酸盐不水解,NaX(NaF除外)不易水解,故A错误;
B.硅的卤化物(SiX4)是由非金属元素原子间通过共用电子对形成的化合物,是共价化合物,故B正确;
C.钠的卤化物(NaX)为离子化合物属于离子晶体,硅的卤化物(SiX4)为共价化合物属于分子晶体,离子晶体的熔点大于分子晶体的熔点,即NaX的熔点一般高于SiX4,故C正确;
D.SiF4晶体是由分子间作用力结合而成,故D错误;
故答案为:SiCl4(g)+2H2(g)→Si(s)+4HCl(g)△H=-0.025akJ/mol; BC;
(3)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷,故硅烷的分解温度远低于甲烷,
故答案为:C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”) Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷;
(4)a.因为随着温度的升高,SiHCl3的转化率增大,平衡右移,则该反应的平衡常数随温度升高而增大,故a正确;
b.增大一种反应物的浓度,能提高其它反应物的转化率,而本身的转化率反而降低,故横坐标表示的投料比应该是$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$,故b错误;
c.SiHCl3(g)+H2(g)?Si(s)+3HCl(g)正向为气体系数减小方向,降低压强平衡向气体系数减小方向移动,可以提高SiHCl3的利用率,故c正确;
故选:a、c;
(5)依据所给数据可知:硅酸的Ki2小于碳酸的Ki2,依据“越弱越水解”可知硅酸钠更易水解,
故答案为:硅酸钠;硅酸的Ki2小于碳酸的Ki2,硅酸钠更易水解.
点评 本题为综合题考查了高炉炼铁原理、热化学方程式书写、化学平衡移动影响因素、盐类水解规律,题目难度中等,注意对化学平衡移动知识的掌握.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案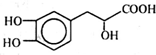
| A. | 丹参素的分子式为C9H10O5 | |
| B. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| C. | 1 mol丹参素在一定条件下与足量金属钠反应可生成2 mol H2 | |
| D. | 丹参素能发生取代、中和、氧化反应等反应 |
| A. | 2mol0.5mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4gNaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1LpH=1的CH3COOH溶液中含有H+数目为0.1NA | |
| D. | 7.8gCaF2固体中含有的共用电子对数目为0.2NA |
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| A. | 气态氢化物水溶液的酸性依次减弱 | |
| B. | 氯水、溴水、碘水都能使淀粉碘化钾试纸变蓝 | |
| C. | 气态氢化物的稳定性随原子序数的增大而增强 | |
| D. | 原子核外最外层电子数随原子序数的增大而增多 |
 的物质的量浓度为( )
的物质的量浓度为( ) mol·L-1 B.
mol·L-1 B. mol·L-1 C.
mol·L-1 C. mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1