��Ŀ����
 PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx
PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx��1����һ���ܱ������У�������Ӧ��C��s��+H2O��g��?CO��g��+H2��g�� ��÷�Ӧ����Ӧ�ǣ�
��2������п�ѧ��������룺�ѿ������뱥��̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״���CH3OH����
����֪�ڳ��³�ѹ�£�2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.6kJ/mol
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
H2O��g��=H2O��1����H=-44.0kJ/mol
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ
���Լ״���������Ӧ�Ƴɵ�ȼ�ϵ����ͼ1��ʾ���õ�ع���������O2Ӧ��
��3����֪��һ�������£�NO��NO2�������з�Ӧ��NO��g��+NO2��g��=N2O3��g����
��H��0 ���÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�ͼ2ʾ��ͼ��˵��tlʱ�̴ﵽƽ��״̬����

��4����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20molSO2��0��l0molO2��0.5���Ӻ�ﵽƽ�⣬��������к�SO30.18mol����v��O2��=
��5��25��ʱ����NH3����ˮ��l00mL 0��lmol?L-�İ�ˮ�����pH=11�����������NH3?H2O�ĵ���ƽ�ⳣ��ԼΪ
���㣺��ѧƽ���Ӱ������,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧ��Դ���͵��,��ѧƽ��ļ���,���������ˮ��Һ�еĵ���ƽ��
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��,����ƽ������Һ��pHר��,�绯ѧר��
��������1��C��s��+H2O��g��?CO��g��+H2��g�� ��÷�ӦΪ���ȷ�Ӧ�����ݻ�ѧ����ʽ��ƽ�ⳣ��������дƽ�ⳣ������С�ܱ��������ݻ����൱������ѹǿ��ƽ���������С�ķ����ƶ�����Ӧ��������
��2���ٸ��ݸ�˹������������
������ԭ���ͼʾ��֪����������缫Ϊ����������Ӧ������ͨ�룬������Ի���д��������Ӧʽ��
��3����ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ��ó���ȷ���ۣ�
��4����ѧ��Ӧ���ʵĶ���������������ʣ�����Ӱ�컯ѧƽ����������ж�ƽ���ƶ�����
��5�����ݰ�ˮ�������ɵ�����笠����Ӻ����������ӣ����ƽ��ʱ�����ӵ�Ũ�ȣ������õ���ȡ�����ƽ�ⳣ���Ĺ�ʽ��⣻
��2���ٸ��ݸ�˹������������
������ԭ���ͼʾ��֪����������缫Ϊ����������Ӧ������ͨ�룬������Ի���д��������Ӧʽ��
��3����ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ��ó���ȷ���ۣ�
��4����ѧ��Ӧ���ʵĶ���������������ʣ�����Ӱ�컯ѧƽ����������ж�ƽ���ƶ�����
��5�����ݰ�ˮ�������ɵ�����笠����Ӻ����������ӣ����ƽ��ʱ�����ӵ�Ũ�ȣ������õ���ȡ�����ƽ�ⳣ���Ĺ�ʽ��⣻
���
�⣺��1��C��s��+H2O��g��?CO��g��+H2��g�� ��÷�ӦΪ���ȷ�Ӧ��C��s��+H2O��g��?CO��g��+H2��g������Ӧ��ƽ�ⳣ��K=
����С�ܱ��������ݻ����൱������ѹǿ��ƽ���������С�ķ����ƶ������淴Ӧ���ʶ����
�ʴ�Ϊ�����ȣ�
���棻���
��2���ٸ��ݸ�˹���ɣ�����֪��Ӧ��-��-�ۡ�4�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=��-1275.6kJ/mol��-��-566.0kJ/mol��-��-44.0kJ/mol����4=442.8kJ?mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
������ԭ���ͼʾ��֪����������缫Ϊ����������Ӧ������ͨ�룬�ʴ�c��ͨ�룬��������CH3OH�ŵ磬���������Ի������ʸ�����ӦΪ��CH3OH+H2O-6e-=CO2��+6H+���ʴ�Ϊ��C��CH3OH+H2O-6e-=CO2��+6H+��
��3��a��ƽ��ʱ�����淴Ӧ����Ӧ��ȣ��ұ��ֲ��䣬��a����
b��ƽ��ʱ����ѧƽ�ⳣ��Ӧ���ֲ��䣬��b��ȷ��
c��ƽ��ʱ�������ʵ����ʵ���Ӧ���ֲ��䣬��c����
d��ƽ��ʱ��NO�İٷֺ������ֲ��䣬��d��ȷ��
�ʴ�Ϊ��bd��
��4��������0.18molSO3ʱ���μӷ�Ӧ�����������ʵ���Ϊx��
2SO2+O2
2SO3
1 2
x 0.18mol
x=0.09mol
v��O2��=
=0.036mol��L-1?min-1��
����ͨ��0.20mol SO2��0.10mol O2��������ѹǿ����ƽ�������������С�ķ����ƶ�����������Ӧ�����ƶ�����ƽ��ʱSO2��ת��������
�ʴ�Ϊ��0.036������
��5����ˮ��ҺpH=11����C��H+���T10-11 mol?L-1��C��0H-���T10-3mol?L-1��
NH3?H2O?NH4++OH-
��ʼ��mol?L-1�� 0.1 0 0
��Ӧ��mol?L-1�� 10-3 10-3 10-3
ƽ�⣨mol?L-1�� 0.1-10-3 10-3 10-3
����NH3?H2O�ĵ���ƽ�ⳣ��ΪKb=
=1.0��10-5mol?L-1��
�ʴ�Ϊ��1.0��10-5mol?L-1��
| c(CO)c(H2) |
| c(H2O) |
�ʴ�Ϊ�����ȣ�
| c(CO)c(H2) |
| c(H2O) |
��2���ٸ��ݸ�˹���ɣ�����֪��Ӧ��-��-�ۡ�4�õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=��-1275.6kJ/mol��-��-566.0kJ/mol��-��-44.0kJ/mol����4=442.8kJ?mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ?mol-1��
������ԭ���ͼʾ��֪����������缫Ϊ����������Ӧ������ͨ�룬�ʴ�c��ͨ�룬��������CH3OH�ŵ磬���������Ի������ʸ�����ӦΪ��CH3OH+H2O-6e-=CO2��+6H+���ʴ�Ϊ��C��CH3OH+H2O-6e-=CO2��+6H+��
��3��a��ƽ��ʱ�����淴Ӧ����Ӧ��ȣ��ұ��ֲ��䣬��a����
b��ƽ��ʱ����ѧƽ�ⳣ��Ӧ���ֲ��䣬��b��ȷ��
c��ƽ��ʱ�������ʵ����ʵ���Ӧ���ֲ��䣬��c����
d��ƽ��ʱ��NO�İٷֺ������ֲ��䣬��d��ȷ��
�ʴ�Ϊ��bd��
��4��������0.18molSO3ʱ���μӷ�Ӧ�����������ʵ���Ϊx��
2SO2+O2
| ||
| �� |
1 2
x 0.18mol
x=0.09mol
v��O2��=
| 0.09mol |
| 5L��0.5min |
����ͨ��0.20mol SO2��0.10mol O2��������ѹǿ����ƽ�������������С�ķ����ƶ�����������Ӧ�����ƶ�����ƽ��ʱSO2��ת��������
�ʴ�Ϊ��0.036������
��5����ˮ��ҺpH=11����C��H+���T10-11 mol?L-1��C��0H-���T10-3mol?L-1��
NH3?H2O?NH4++OH-
��ʼ��mol?L-1�� 0.1 0 0
��Ӧ��mol?L-1�� 10-3 10-3 10-3
ƽ�⣨mol?L-1�� 0.1-10-3 10-3 10-3
����NH3?H2O�ĵ���ƽ�ⳣ��ΪKb=
| 10 -3��10 -3 |
| 0.1-10 -3 |
�ʴ�Ϊ��1.0��10-5mol?L-1��
���������⿼�����Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�ã�ԭ���ԭ���͵缫��Ӧ��д����ѧƽ��״̬�жϣ���Ӧ���ʼ��㣬ע��������ʵ���ƽ�ⳣ���ļ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
���й������ʷ����˵����ȷ���ǣ�������
| A��Na2O2�pCaO�pK2O���Ǽ��������� |
| B��BaSO4�pNaCl�pKNO3��Һ���ǵ���� |
| C������p�ռ�p��ʯ�Ҷ��Ǽ� |
| D��ϡ�����p�����p������Һ���ǽ��� |
����װ����ʾ��ʵ���У��ܴﵽʵ��Ŀ���ǣ�������
A�� ʵ���ư��� |
B�� ��ȥCl2�е�HCl |
C�� Na2CO3��NaHCO3���ȶ��ԱȽ� |
D�� ����Ʒ�����п |
������ʵ��װ�ý�����Ӧʵ�飬���ܴﵽʵ��Ŀ���ǣ�������
A�� ����������β������װ�� |
B�� ������̼����Ȫʵ�� |
C�� �Ʊ����ռ����� |
D�� �ռ�NO���� |
Na2HPO4��Һ�д������е���ƽ��HPO42-?H++PO43-����ʹ��Һ�е�c��HPO42-����c��H+����c��PO43-�������٣��ɲ�ȡ�ķ����ǣ�����������֪HPO42-ˮ����ڵ��룩
| A����ŨHCl |
| B������ʯ�� |
| C�����ռ�� |
| D����NaCl��Һ |
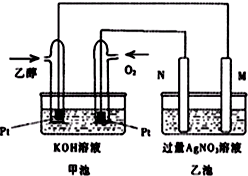 ��ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺
��ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺