题目内容
 某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究.
某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究.(1)根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验.实验中使用肥皂液检验的产物是
(2)甲同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:(查阅资料可知:Fe3O4+8HCl(浓)
| ||
| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产 生,溶液呈浅绿色. |
| ② | 向上述烧杯中滴加几滴KSCN溶 液,充分振荡 | 溶液没有出现红色 |
(3)乙同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4.
| 实验序号 | 实验操作 | 实验现象 |
| ① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色. |
| ② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
| ③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)装置图探究还原铁粉与水蒸气的反应及产物,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说明有氢气生成,肥皂液检验反应中生成的H2 ;湿棉花的作用提供水蒸气反应物,铁和水蒸气高温反应生成四氧化三铁和氢气;
(2)铁与盐酸反应有气泡冒出;Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+;
(3)依据实验过程分析,最后得到红褐色固体21,4g为氧化铁,结合铁元素守恒计算得到四氧化三铁质量.
(2)铁与盐酸反应有气泡冒出;Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+;
(3)依据实验过程分析,最后得到红褐色固体21,4g为氧化铁,结合铁元素守恒计算得到四氧化三铁质量.
解答:
解:(1)装置图探究还原铁粉与水蒸气的反应及产物,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声说明有氢气生成,肥皂液检验反应中生成的H2 ;湿棉花的作用提供水蒸气反应物,铁和水蒸气高温反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)=Fe3O4+4H2,
故答案为:H2,产生水蒸气,3Fe+4H2O(g)=Fe3O4+4H2;
(2)与盐酸反应有气泡冒出说明含有铁;不能确定是否含有Fe3O4或FeO,如果混合物中存在Fe3O4,溶于盐酸生成的 Fe3+与 Fe反应生成了 Fe2+;且溶液中的 Fe2+也有可能是 Fe与 Fe3+反应的产物,肯定能确定残留黑色固体中含有的一种物质是Fe,
故答案为:Fe;
(3)称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色,说明含有铁和四氧化三铁,反应后全部变化为亚铁盐,向上述烧杯中加入足量的氯水,充分振荡溶液呈黄色,向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量,得到21.4g红褐色固体,为氢氧化铁质量,物质的量=
=0.2mol;设残留黑色固体中Fe3O4的物质的量为x,Fe物质的量为y,依据元素守恒列式计算,
232x+56y=14.4
3x+y=0.2
x=0.05
y=0.05
Fe3O4的终质量=232g/mol×0.05mol=11.6g
故答案为:11.6.
故答案为:H2,产生水蒸气,3Fe+4H2O(g)=Fe3O4+4H2;
(2)与盐酸反应有气泡冒出说明含有铁;不能确定是否含有Fe3O4或FeO,如果混合物中存在Fe3O4,溶于盐酸生成的 Fe3+与 Fe反应生成了 Fe2+;且溶液中的 Fe2+也有可能是 Fe与 Fe3+反应的产物,肯定能确定残留黑色固体中含有的一种物质是Fe,
故答案为:Fe;
(3)称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色,说明含有铁和四氧化三铁,反应后全部变化为亚铁盐,向上述烧杯中加入足量的氯水,充分振荡溶液呈黄色,向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量,得到21.4g红褐色固体,为氢氧化铁质量,物质的量=
| 2.14g |
| 107g/mol |
232x+56y=14.4
3x+y=0.2
x=0.05
y=0.05
Fe3O4的终质量=232g/mol×0.05mol=11.6g
故答案为:11.6.
点评:本题考查铁及其化合物的性质,难度中等,(3)中的计算是难点,学生应充分利用信息并结合元素守恒法来综合应用解答本题,掌握反应现象的分析方法和产物判断是解题关键.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列实验操作中所用仪器合理的是( )
| A、用100 mL的量筒量取18.8 mL NaOH溶液 |
| B、用瓷坩埚加热熔融NaOH |
| C、用托盘天平称取25.2 0g氯化钠 |
| D、用100 m L容量瓶制备7 0 mL0.1 mo l?L-1盐酸 |
1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能.下列热化学方程中,能直接表示出氯化钠晶体格能的是( )
| A、Na+(g)+Cl-(g)═NaCl(s);△H | ||
B、Na(s)+
| ||
| C、Na(s)═Na(g);△H2 | ||
| D、Na(g)-e-═Na+ (g);△H |
下列各图示实验设计和操作合理的是( )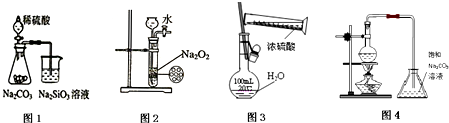

| A、图1 证明非金属性强弱:S>C>Si |
| B、图2 制备少量氧气 |
| C、图3 配制一定物质的量浓度的硫酸溶液 |
| D、图4 制备少量乙酸丁酯 |





