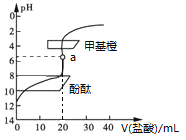
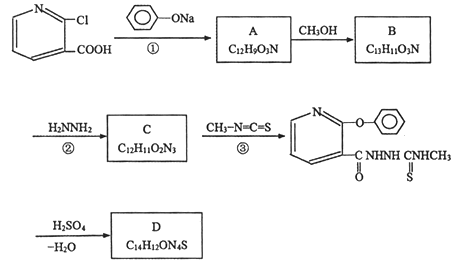
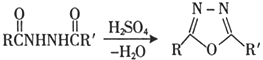
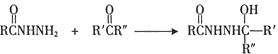题目内容
【题目】在200℃和a℃时,反应X(g) ![]() 4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
4Y(g)+Z(g)中X的浓度随时间变化的关系如图所示。
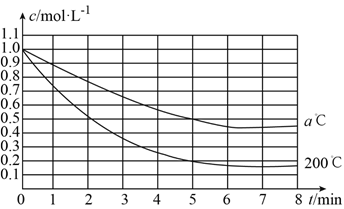
(1)200℃时5min内用Y表示的平均反应速率为__________。
(2)200℃、8min时,Z的浓度为__________。
(3)200℃时,在__________时,反应达到平衡状态。
(4)200℃、7min时,v正__________v逆(填“>”、“<”或“=”)。
(5)从图中可以看出,a__________200(填“>”、“<”或“=”)。
【答案】 0.64 mol/(L·min) 0.85 mol·L-1 6 min = <
【解析】(1)5min内X浓度变化为1.0mol/L-0.2mol/L=0.8mol/L,v(X)= ![]() =0.016molL-1min-1,v(Y)=4×0.016molL-1min-1=0.64molL-1min-1,故答案为:0.64molL-1min-1;
=0.016molL-1min-1,v(Y)=4×0.016molL-1min-1=0.64molL-1min-1,故答案为:0.64molL-1min-1;
(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,故答案为:0.85mol/L;
(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,故答案为:6min;
(4)7min达到化学平衡状态,V(正)=V(逆),故答案为:=;
(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃后达到平衡状态,故a<200,故答案为:<。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目