题目内容
某同学利用如图装置制NO并进行相关实验探究。
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是 ,在步骤3中可以观察到的现象为 。
(4)在铜丝上绑上石墨的作用是 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分)
(2)还原 (2分)
(3)检查装置的气密性(2分);u型管短管中溶液与铜丝接触反应;有气泡产生,溶液变蓝色,铜丝减少(2分)
(4)形成原电池,加快反应速率(2分)
(5)方案一: 实验步骤 实验现象 实验结论 ②将二支注射器分别插入装有热水、冰水的烧杯中(1分);几分钟后拿出作对比。(1分) 浸入热水的注射器中的气体颜色变深;(1分)
浸入冰水的注射器中的气体颜色变浅。(1分) 在其他条件不变的情况下(1分),温度升高,会使化学平衡向着吸热反应的方向移动;温度降低会使化学平衡向放热反应的方向移动(1分)(只答一方面也给1分)
或:方案二: 实验步骤 实验现象 实验结论 ②将一支注射器的活塞迅速往里推到一定位置,然后与另一支注射器的气体作对比(1分);回复原状后再将注射器的活塞迅速往外拉到一定位置,然后与另一支注射器的气体作对比(1分) 迅速推动注射器,针管内气体颜色先变深后慢慢变浅(1分);迅速拉伸注射器时,针管内气体颜色先变浅后深慢慢变深。(1分) 在其他条件不变的情况下(1分),增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。(1分)(只答一方面也给1分)
解析试题分析:(1)从右图装置可以看出,该装置利用铜丝和稀硝酸接触反应制备NO,所以发生的反应方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(2)NO与空气混合变红是由于NO被O2氧化生成了红棕色的NO2,所以体现了NO较强的还原性。
(3)该装置是一个制备NO气体的实验装置,制备气体的装置都要检查装置的气密性,所以在所给出的步骤中漏了检查气密性的步骤。该装置用注射器抽走U形管左侧液面上方的空气后压强减小,所以液体硝酸会充满左端并与金属Cu接触发生反应,所以发生反应后观察到的实验现象是U型管短管中溶液与铜丝接触反应,有气泡产生,溶液变蓝色,铜丝溶解减少;由于有气体产生左边液面下降,右边液面上升。
(4)在铜丝上绑上石墨,石墨并不参与反应,但是石墨可以和铜丝构成原电池,石墨作正极,所以可以加快反应制备NO气体。
(5)本题要注意的是题目要求实验探究的目的是外界因素对化学平衡移动影响,所以实验中应该在其他条件不变的情况下,改变某一条件,从而观察现象,由现象得出该反应的实验结论。给出的已知反应方程式能提供的信息是反应有气体参加且正反应是放热反应,NO2有颜色,而N2O4 无色。所以能够控制的使该反应平衡发生改变的条件可以是压强(容器体积)和温度。由于注射器做容器已经在步骤①固定,所以还需要实验的步骤就是改变条件了,要利用好教材中出现的该实验,同时也不要受教材中出现的实验影响而去改变容器,所以合理的实验如下表:方案一: 实验步骤 实验现象 实验结论 ②将二支注射器分别插入装有热水、冰水的烧杯中(1分);几分钟后拿出作对比。(1分) 浸入热水的注射器中的气体颜色变深;(1分)
浸入冰水的注射器中的气体颜色变浅。(1分) 在其他条件不变的情况下(1分),温度升高,会使化学平衡向着吸热反应的方向移动;温度降低会使化学平衡向放热反应的方向移动(1分)(只答一方面也给1分)
或:方案二: 实验步骤 实验现象 实验结论 ②将一支注射器的活塞迅速往里推到一定位置,然后与另一支注射器的气体作对比(1分);回复原状后再将注射器的活塞迅速往外拉到一定位置,然后与另一支注射器的气体作对比(1分) 迅速推动注射器,针管内气体颜色先变深后慢慢变浅(1分);迅速拉伸注射器时,针管内气体颜色先变浅后深慢慢变深。(1分) 在其他条件不变的情况下(1分),增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。(1分)(只答一方面也给1分)
考点:本题考查的是比较基础的实验探究题,该实验题衔接教材注重细节的考查。

某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)已知I2+I- I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
| | 操作 | 实验现象 |
| a | 取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色, 水层显浅黄色。 |
| b | 取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色,水层几近无色。 |
① 实验b的目的是 。
② 根据实验a中,水层中含有的粒子有 。
③ 实验a中水溶液颜色变浅的原因是 。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(2)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(3) 根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有 。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式 。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 ;SiHCl3极易水解,其完全水解的产物为 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(4)还原炉中发生的化学反应为: 。
(5)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_______性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有_______性。
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是_______ (填序号)。
①Cu+HNO3(浓) Cu(NO3)2
Cu(NO3)2
②Cu+HNO3(稀) Cu(NO3)2
Cu(NO3)2
③
(3)①在100 mL 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_______
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为__________________________________________。
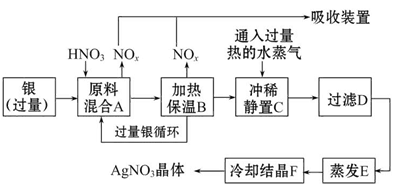
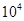 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。