��Ŀ����
����Ŀ������ȫ�������������أ�Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����е������̼���������Ⱦ����һ����Ҫ����Ĺ�����
I������������о�
��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ�� 2NO(g)+O2(g) ![]() 2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______
2NO2(g)������״̬��˵���÷�Ӧ�ﵽ��ѧƽ�����_______
A�����������ܶȱ��ֲ��� B��NO��ת���ʱ��ֲ���
C��NO��O2�����ʵ���֮�ȱ��ֲ��� D��O2���������ʺ�NO2�������������
��2����֪��Ӧ��2NO(g) ![]() N2(g)+O2(g) ��H<0���ڲ�ͬ����ʱN2�����������ʱ��(t)�ı仯��ͼ��ʾ������ͼ������ж�����R1��R2��Ӧ�������з�Ӧ�����е�______ (����ĸ���)��
N2(g)+O2(g) ��H<0���ڲ�ͬ����ʱN2�����������ʱ��(t)�ı仯��ͼ��ʾ������ͼ������ж�����R1��R2��Ӧ�������з�Ӧ�����е�______ (����ĸ���)��
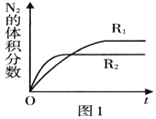
A��ѹǿ B���¶� C������
������ͼ�е������仯���ݣ����㷴Ӧ��2NO(g) ![]() N2(g)+O2(g) �Ħ�H=__________
N2(g)+O2(g) �Ħ�H=__________
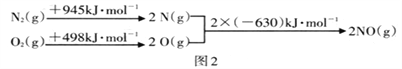
II��̼��������о�
��3��CO��H2��һ�������¿��Ժϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H<0,�������Ϊ1L�ĺ����ܱ�����(��ͼ��)��ͨ��1molCO��2molH2���ⶨ��ͬʱ�䡢��ͬ�¶�(T)��������CO�����ʵ��������±���
CH3OH(g) ��H<0,�������Ϊ1L�ĺ����ܱ�����(��ͼ��)��ͨ��1molCO��2molH2���ⶨ��ͬʱ�䡢��ͬ�¶�(T)��������CO�����ʵ��������±���

��ش�
T1_____ T2���>����<����=��������֪T2��ʱ����20minʱ������ѹǿ���ٸı䣬��ʱH2��ת����Ϊ_________ ��
��4����֪��Ksp[Al(OH)3]��1��10��33��Ksp[Fe(OH)3]��3��10��39��pH��7.1ʱMn(OH)2��ʼ�����������£���ȥMnSO4��Һ�е�Fe3����Al3��(ʹ��Ũ�Ⱦ�С��1��10��6 mol��L��1)���������ҺpH��ΧΪ________��
���𰸡� BC B ��183kJ.mol-1 �� 50%��0.5 5.0��pH��7.1
��������(1)�жϻ�ѧ��Ӧ�Ƿ�ﵽƽ�����ͨ�����淴Ӧ������Ȼ����ֵ�ijһ���������ֲ��������A���ں����ܱ�����������ѧƽ��2NO(g)+O2(g) ![]() 2NO2(g) �Ļ��������ܶ�ʼ�ձ��ֲ�������A����ȷ��NO��ת���ʱ��ֲ����Լ�NO��O2�����ʵ���֮�ȱ��ֲ��䶼��ȷ����Ӧ�Ѿ��ﵽƽ��״̬������B��C����ȷ��D��O2����������������Ӧ���ʣ�NO2�������������淴Ӧ���ʣ����������������ڷ�Ӧ�еĻ�ѧ��������ͬ�����Զ�����Ȳ���˵���ﵽƽ��״̬��D������ȷ��ΪBC��
2NO2(g) �Ļ��������ܶ�ʼ�ձ��ֲ�������A����ȷ��NO��ת���ʱ��ֲ����Լ�NO��O2�����ʵ���֮�ȱ��ֲ��䶼��ȷ����Ӧ�Ѿ��ﵽƽ��״̬������B��C����ȷ��D��O2����������������Ӧ���ʣ�NO2�������������淴Ӧ���ʣ����������������ڷ�Ӧ�еĻ�ѧ��������ͬ�����Զ�����Ȳ���˵���ﵽƽ��״̬��D������ȷ��ΪBC��
(2) ��֪2NO(g) ![]() N2(g)+O2(g) ��H<0����ͼ���֪��R2�����R1�����ʼӿ��ˣ�ƽ�����淴Ӧ�ƶ��ˣ�����һ����Ӧǰ�������������ķ��ȷ�Ӧ�����Լ�ѹƽ�ⲻ�ƶ���ʹ�ô���ƽ��Ҳ���ƶ�������ֻ���¶ȷ���Ҫ��ѡB��
N2(g)+O2(g) ��H<0����ͼ���֪��R2�����R1�����ʼӿ��ˣ�ƽ�����淴Ӧ�ƶ��ˣ�����һ����Ӧǰ�������������ķ��ȷ�Ӧ�����Լ�ѹƽ�ⲻ�ƶ���ʹ�ô���ƽ��Ҳ���ƶ�������ֻ���¶ȷ���Ҫ��ѡB��
��H=��Ӧ����ܼ�������������ܼ���=2��630kJ/mol��(945 kJ/mol+498 kJ/mol)= -183 kJ/mol��
(3)�ɱ������ݿ�֪������ͬʱ�����T2��Ӧ��CO���٣�˵����Ӧ���ʿ�����T2��Ӧ���¶ȸ���T1����T1< T2��

����H2��ת����Ϊ=![]() ������0.5����
������0.5����
(4)�����£�Ҫ��ȥMnSO4��Һ�е�Fe3����Al3��������pH��7.1ʱMn(OH)2��ʼ���������Կ���pHһ��С��7.1����Ksp[Al(OH)3]��1��10��33��Ksp[Fe(OH)3]��3��10��39��֪����Al3��������ȫʱ��Fe3��Ҳ������ȫ����������Ksp[Al(OH)3]��c(Al3��) ��c(OH��)3=1��10��6 ��c(OH��)3=1��10��33�����c(OH��)= 1��10��9 mol��L��1����pH=5.0������ȷ��Ϊ5.0��pH��7.1

 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�