题目内容
4.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况屯的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
分析 由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,以此解答该题.
解答 解:由题给的条件可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;
根据Y与M形成的气态化合物在标准状况下的密度0.76g•L-1,就可计算出该气态化合物的摩尔质量为22.4L/mol×0.76g•L-1=17g/mol,从而确定M为H元素;
根据W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,推出W的质子数为$\frac{1}{2}$(6+7+8+1)=11,所以W为Na元素,
A.原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),故A错误;
B.X为C元素,对应的单质有金刚石、石墨等几种同素异形体,故B正确;
C.选项中CO2、C2H2 均为直线型共价化合物,而Na2O2 是离子化合物,不是直线型共价化合物,故C错误;
D.X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,故D错误.
故选B.
点评 本题综合考查原子结构,元素周期表、元素周期律,分子结构,元素化合物性质等知识,试题难度不大,但题目一反通常习惯,把X、Y、Z、M、W这五种短周期元素,并不是按原子序数依次递增排列的,而只是其中X、Y、Z三种元素是原子序数依次递增的同周期元素,而把原子序数最小的M元素恰恰排在X、Y、Z三种元素后面,这样就给学生设置了一个思维陷阱,如果学生不注意审题,不注意这一细节,一旦陷入习惯上的思维定势,就会跌入这个陷阱,无法正确解题.这也是本题的解题关键.只要掌握了这一解题关键,再结合题给的条件,题目就可迎刃而解.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
(1)网络与人们的生活密切相关,传导网络数据的光导纤维的主要成方的化学式是SiO2.
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料,其中,生产普通玻璃的主要原料有石英砂、纯碱、石灰石.
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
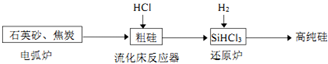
①石英砂和焦炭在电弧炉中高温加热生产粗碳反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,则流化床主要发生反应的化学反应方程式为2Si(粗硅)+6HCl=2SiHCl3+2H2↑.产物中分子结构为正四面体的物质的名称为四氯化硅或四氯硅烷.
③有关物质的沸点数据如下表.
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
(2)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2或Na2SiO3.
(5)已知单质X的燃烧热为296kJ/mo1,1mo1XM2(g)被氧化为1mo1XM3(g)的△H=-99kJ/mo1.写出由XM2生成XM3的热化学反应方程式2SO2(g)+O2=2SO3(g)△H=-198kJ/mol,计算由X(s)生成3mo1XM3(g)的△H=-1185kJ/mol.
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
| A. | HA的pH=3;BOH的pH=13 | |
| B. | pH=a的HA溶液,稀释10倍,其pH=a+1 | |
| C. | 等体积的HA和BOH恰好完全反应,溶液的pH=7 | |
| D. | 相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同 |