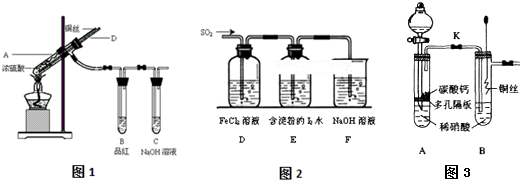
题目内容
11.现有一由Na2SO4、Na2SO3、Na2S组成的混和物,经测定硫的质量分数为2 5.6%,则此混合物中氧元素的质量分数应为( )| A. | 37.6% | B. | 36.8% | C. | 25.6% | D. | 51.2% |
分析 根据所给物质的化学式进行分析,可以发现,在这三种物质中,钠元素与硫元素的原子个数比为2:1,也就是钠元素和硫元素的质量比是定值46:32,根据硫元素的质量分数为25.6%计算钠元素的质量分数,氧元素的质量分数为1-ω(Na)-ω(S),从而确定氧元素的质量分数.
解答 解:在这三种物质中,钠元素与硫元素的原子个数比为2:1,也就是钠元素和硫元素的质量比是定值为46:32,硫元素的质量分数为25.6%,所以钠元素的质量分数是25.6%×$\frac{46}{32}$=36.8%,故氧元素的质量分数为:1-25.6%-36.8%=37.6%.
故选:A.
点评 本题考查了混合物的计算、质量分数计算等,难度中等,根据化学式判断物质中Na、S元素的质量比是解题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
19.下列实验装置设计正确的是( )
| A. | 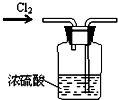 干燥氯气 | B. |  稀释浓硫酸 | ||
| C. |  实验室制氨气 | D. | 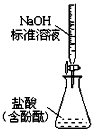 测定盐酸浓度 |
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
16.有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl-,可能有NH4+ | |
| B. | 肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- | |
| C. | 肯定有K+、Al3+、MnO4-,可能有HCO3- | |
| D. | 肯定有Al3+、Mg2+、Cl-,可能有K+ |
3.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式为:Zn+2 OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-,总反应式为Ag2O+Zn=ZnO+2Ag,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
1.某溶液中含有的离子是K+、NH4+、Fe2+、Fe3+、A13+、AlO2-、SO42-、CO32-、SiO32-、Cl-、NO3-中的某几种,已知各微粒的浓度均为0.1mol•L-1.现进行如下实验:
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生.
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色.
根据上述实验事实推断,有关该溶液的说法错误的是( )
①取少量溶液加入足量的NaOH浓溶液,最终得到红褐色沉淀,并伴有气泡产生,过滤后的滤液中逐滴滴加稀硫酸至过量,过程中无沉淀产生.
②另取少量原溶液,加入稀硫酸溶液,有气体产生,并在空气中变为红色.
根据上述实验事实推断,有关该溶液的说法错误的是( )
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
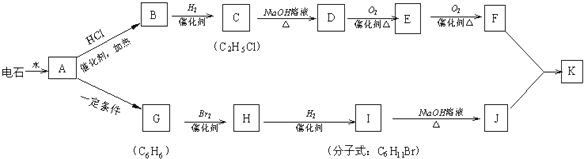
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.