题目内容
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3的反应:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)△H=Q kJ?mol-1.2min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1mol?L-1和0.2mol?L-1.
(1)从反应开始到平衡,v(SiCl4)= .
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”).
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”).
(4)原容器中,通入H2的体积(标准状况下)为 .
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为 .
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a b(填“>”、“<”或“=”).
(1)从反应开始到平衡,v(SiCl4)=
(2)该反应的平衡常数表达式为K=
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将
(4)原容器中,通入H2的体积(标准状况下)为
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a

考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始H2物质的量以及2分钟时转化的物质的量,在根据则则v(H2)=
,计算出氢气的反应速率,最后根据反应速率之比等于系数之比求出v(SiCl4);
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,注意纯固体或者纯液体不列出;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩增大压强平衡向着体积减小的方向移动即正方向移动,故
H2的体积分数将减小;
(4)根据(1)三段分析法进行计算;
(5)平衡后,将容器的体积缩为10L,相当于增大压强平衡要向正方向移动进行判断;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b.
| △C(H 2) |
| △t |
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,注意纯固体或者纯液体不列出;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩增大压强平衡向着体积减小的方向移动即正方向移动,故
H2的体积分数将减小;
(4)根据(1)三段分析法进行计算;
(5)平衡后,将容器的体积缩为10L,相当于增大压强平衡要向正方向移动进行判断;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b.
解答:
解:(1)由 3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
4x=0.2mol/L×20L=4mol,x=1mol,
n-2x=0.1mol/L×20L=2mol,n=4mol,
则v(H2)=
=
=0.05mol?L-1?min-1,根据反应速率之比等于系数之比可得v(SiCl4)=
v(H2)=0.075mol?L-1?min-1
故答案:0.075mol?L-1?min-1;
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,K=
;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向,所以Q>0;
故答案:K=
;>;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩相当于增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;故答案:减小;
(4)根据(1)三段分析法计算得,通入H2的体积(标准状况下)为4mol×22.4mol/L=89.6L,故答案:89.6L;
(5)平衡后,将容器的体积缩为10L,如果平衡不移动H2的物质的量浓度变成原来的2倍即
×2=0.2mol/L,但是体积压缩相当于增大压强平衡要向正方向移动进行,H2的物质的量浓度还要减小,但根据勒夏特列原理,再减小也会比原来的大;故答案:0.1mol?L-1<c(H2)<0.2mol?L-1;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b;故答案:>.
 4SiHCl3(g)
4SiHCl3(g)起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
4x=0.2mol/L×20L=4mol,x=1mol,
n-2x=0.1mol/L×20L=2mol,n=4mol,
则v(H2)=
| △C(H 2) |
| △t |
| ||
| 2min |
| 3 |
| 2 |
故答案:0.075mol?L-1?min-1;
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,K=
| C 4(SiHCl3) |
| C 3(SiCl 4)C 2(H 2) |
故答案:K=
| C 4(SiHCl3) |
| C 3(SiCl 4)C 2(H 2) |
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩相当于增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;故答案:减小;
(4)根据(1)三段分析法计算得,通入H2的体积(标准状况下)为4mol×22.4mol/L=89.6L,故答案:89.6L;
(5)平衡后,将容器的体积缩为10L,如果平衡不移动H2的物质的量浓度变成原来的2倍即
| 2mol |
| 20L |
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b;故答案:>.
点评:本题考查化学平衡的计算、化学平衡移动原理,等效平衡的思想等知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
测定某含有Na2CO3杂质的NaHCO3样品的纯度,现将20g样品加热,再将产生的CO2和水蒸气通入足量的Na2O2中,发现Na2O2固体增重3g,该样品的纯度(质量分数)是( )
| A、50% | B、84% |
| C、42% | D、16% |
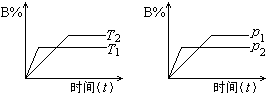 已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)+Q(Q为热量变化).在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )| A、T1<T2,p1>p2,m+n>p,Q<0 |
| B、T1>T2,p2>p1,m+n>p,Q<0 |
| C、T1>T2,p2>p1,m+n<p,Q<0 |
| D、T1>T2,p1<p2,m+n>p,Q>0 |
下列叙述不正确的是( )
| A、在基态多电子的原子中,最易失去的电子能量最高电离能也最小 |
| B、锗的第一电离能高于碳而电负性低于碳 |
| C、PH3分子呈三角锥形,沸点比NH3低 |
| D、SiF4和SO32-的中心原子均为sp3杂化 |
一定量的Fe和Fe2O3混合物投入1mol?L-1 300mL 的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标准状况),再向反应后溶液中加入1mol?L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
| A、200mL |
| B、245mL |
| C、250mL |
| D、300mL |
下列实验操作中,不合理的是( )
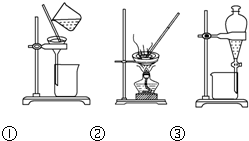

| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
下列装置或操作能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 制取乙酸乙酯 |
D、 石油的分馏 |
