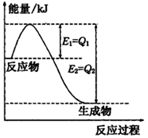
题目内容
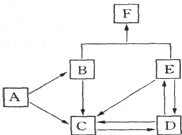 如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.
如图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去).其中A是单质,D在常温下呈气态,F可用作氮肥.据此,请回答下列问题:
(1)写出以下物质的化学式:A
N2
N2
,DNO2
NO2
,FNH4NO3
NH4NO3
.(2)写出下列变化的化学方程式:
B→C
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
E→C
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
.分析:某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去),F可用作氮肥,则F为铵盐,且这几种物质中都含有相同元素,A是单质,A能转化为B和C,B和E反应生成铵盐,且都含有相同元素,则A是N2,B是NH3,氮气和氧气反应生成NO,所以C是NO,D在常温下呈气态,一氧化氮和氧气反应生成D,则D为NO2,二元化氮和水反应生成硝酸和一氧化氮,硝酸被还原生成二氧化氮,所以E是HNO3,F是NH4NO3.
解答:解:某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去),F可用作氮肥,则F为铵盐,且这几种物质中都含有相同元素,A是单质,A能转化为B和C,B和E反应生成铵盐,且都含有相同元素,则A是N2,B是NH3,氮气和氧气反应生成NO,所以C是NO,D在常温下呈气态,一氧化氮和氧气反应生成D,则D为NO2,二元化氮和水反应生成硝酸和一氧化氮,硝酸被还原生成二氧化氮,所以E是HNO3,F是NH4NO3,
(1)通过以上分析知,A、D、F分别是N2、NO2、NH4NO3,
故答案为:N2;NO2;NH4NO3;
(2)B是NH3,C是NO,氨气被催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2
4NO+6H2O,
E是HNO3,铜和稀硝酸反应生成一氧化氮,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:4NH3+5O2
4NO+6H2O;3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O.
(1)通过以上分析知,A、D、F分别是N2、NO2、NH4NO3,
故答案为:N2;NO2;NH4NO3;
(2)B是NH3,C是NO,氨气被催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2
| ||
| △ |
E是HNO3,铜和稀硝酸反应生成一氧化氮,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:4NH3+5O2
| ||
| △ |
点评:本题以N元素为载体考查了物质间的转化,明确物质的性质是解本题关键,以F为突破口采用正逆相结合的方法推断,再结合氮气的性质分析解答,难度中等.

练习册系列答案
相关题目
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式______.若在反应体系中加入催化剂使反应速率增大,则E1的变化是______,该反应的反应热△H______(填“增大”“减小”或“不变”).
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1
则反应CO(g)+ O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)=2NH3(g)+ O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1
为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
此合成反应中,a______0;△s______0,(填“>”、“<”或“=”)
(4)在一固定容积为2L的密闭容器内加人2mol NH3和3mol O2,发生反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),2min后达到平衡,生成1.2mol NO.则前2分钟的平均反应速率v(NH3)为______,平衡时O2的转化率为______,该反应平衡常数的表达式K=______.
(5)某温度下,体积均为0.25L的两个恒容密闭容器中发生下列反应:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
容器B中反应达到平衡状态时的反应热△H2=______.
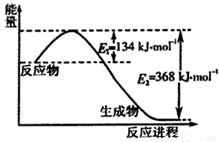
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式______.若在反应体系中加入催化剂使反应速率增大,则E1的变化是______,该反应的反应热△H______(填“增大”“减小”或“不变”).
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJ?mol-1
则反应CO(g)+
 O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)=2NH3(g)+
 O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(4)在一固定容积为2L的密闭容器内加人2mol NH3和3mol O2,发生反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),2min后达到平衡,生成1.2mol NO.则前2分钟的平均反应速率v(NH3)为______,平衡时O2的转化率为______,该反应平衡常数的表达式K=______.
(5)某温度下,体积均为0.25L的两个恒容密闭容器中发生下列反应:N2(g)+3H2(g)
 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | △H1=-23.1 | |
| B | 0.9 | 2.7 | 0.2 | △H2 |

 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K= 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)  _____
_____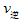 (填“>”“<”或“=”)
(填“>”“<”或“=”)