题目内容
5.将3.45g钠投入一定量的水中,充分反应,所得溶液加水稀释到500mL.求:(1)反应中生成的H2在标准状况下的体积
(2)所得溶液中溶质的物质的量浓度.
分析 (1)钠与水完全反应,根据n=$\frac{m}{M}$计算出3.45g钠的物质的量,然后利用电子守恒计算出生成氢气的物质的量,最高价V=nVm计算出生成氢气在标准状况下的体积;
(2)根据钠元素守恒可知氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:(1)3.45g Na的物质的量为:$\frac{3.45g}{23g/mol}$=0.15mol,钠与水会完全反应,根据电子守恒可知生成氢气的物质的量为:$\frac{0.15mol×1}{2}$=0.075mol,标准状况下0.075mol氢气在标准状况下的体积为:22.4L/mol×0.075mol=1.68L,
答:反应中生成的H2在标准状况下的体积为1.68L;
(2)根据Na元素守恒可知生成NaOH的物质的量为0.15mol,则所得溶液中氢氧化钠的物质的量浓度为:$\frac{0.15mol}{0.5L}$=0.3 mol•L-1,
答:所得溶液中溶质的物质的量浓度为0.3 mol•L-1.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
13.水的电离过程为H2O?H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为2×10-7mol/L |
10.进行下列反应后,所得溶液中一定只含有一种溶质的是( )
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
17.在0.2mol/L的CH3COOH溶液中分别加入下列物质或升高温度后,有关判断正确的是( )
| A. | 适当升高温度,CH3COOH的电离程度减小 | |
| B. | 加少量NaOH固体,CH3COOH的电离平衡向正方向移动 | |
| C. | 加少量0.2 mol/L 的HCl溶液,溶液中c(H+)增大,平衡向正方向移动 | |
| D. | 加少量CH3COONa固体,CH3COOH的电离平衡向正方向移动 |
14.下列说法正确的是( )
| A. | 一氯代物只有一种的烷烃只能是甲烷 | |
| B. | 二氯甲烷无同分异构体,说明甲烷分子是正四面体结构 | |
| C. | 组成上相差一个或多个CH2的有机物一定互为同系物 | |
| D. | 能使酸性高能酸钾溶液褪色的烃一定含有C=C或C≡C |
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: .
.
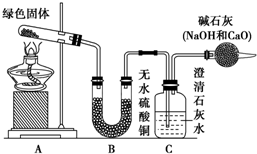 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.