题目内容
根据如图所示的装置,判断下列说法不正确的是( )


| A、该装置中铜为阳极 |
| B、当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C、该装置中b极的电极反应式是:H2+2OH--2e-═2H2O |
| D、该装置中a极为正极,发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:左边装置是原电池,氢氧原料原电池中,投放燃料的电极是负极,负极上失电子发生氧化反应,投放氧化剂的电极是正极,正极上发生还原反应;右边装置是电解池,电解池阳极上失电子发生氧化反应,阴极上得电子发生还原反应,据此分析解答.
解答:
解:A、右边装置是电解池,铜电极连接原电池的正极,所以铜电极是电解池的阳极,故A正确.
B、根据放电过程中,根据得失电子数相等计算消耗氧气的体积,设消耗氧气的体积为v.
根据得失电子数相等得氧气和铜的关系式为:
O2------2Cu
22.4L 128g
V 12.8g
V=
=2.24L,故B正确.
C、左边装置是原电池,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:H2+2OH--2e-═2H2O,故C正确.
D、左边装置是原电池,正极上氧气得电子发生还原反应,故D错误.
故选D.
B、根据放电过程中,根据得失电子数相等计算消耗氧气的体积,设消耗氧气的体积为v.
根据得失电子数相等得氧气和铜的关系式为:
O2------2Cu
22.4L 128g
V 12.8g
V=
| 12.8g×22.4L |
| 128g |
C、左边装置是原电池,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:H2+2OH--2e-═2H2O,故C正确.
D、左边装置是原电池,正极上氧气得电子发生还原反应,故D错误.
故选D.
点评:本题考查了原电池和电解池原理,难度不大,注意氢氧燃料电池中电极反应式的书写,书写时要结合电解质溶液的酸碱性,酸碱性不同,电极反应式的书写不同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据下列化学实验事实得出的结论一定正确的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解.结论:该溶液中含有SO42- |
| B、向某无色溶液中加入足量盐酸,产生能使澄清石灰水变浑浊的气体.结论:该溶液中含有CO32-或HCO3- |
| C、向1 mL浓度均为0.05 mol/L的NaCl、NaI混合溶液中滴加2滴0.01 mol/L的AgNO3溶液,振荡,沉淀呈黄色.结论:Ksp(AgCl)<Ksp(AgI) |
| D、向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝.结论:该溶液中有NH4+ |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴入石蕊试液显蓝色的溶液中:K+、Na-、HSO3-、ClO- |
| B、0.1mol?L-l的Fe(NO3)2溶液中:Na+、H+、SCN-、I- |
| C、0.1mol?L-l的NaAlO2溶液中:K+、H+、NO3-、SO42- |
| D、由水电离产生的c(H+)=1×10-13mol?L-l的溶液中:Na+、Ba2+、NO3-、Cl- |
下列关于Na2O和Na2O2的叙述正确的是( )
| A、都是白色的固体 |
| B、都是碱性氧化物 |
| C、都是强氧化剂 |
| D、都能与水反应形成强碱溶液 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,2.24 L SO3含有分子的数目为0.1NA |
| B、1 mol O2与Na完全反应,转移电子数一定为4NA |
| C、常温常压下,1.6 g CH4中含有共价键的数目为0.4NA |
| D、将2 mL 0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目为0.001NA |


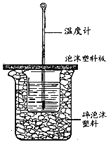 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: