题目内容
已知在100mlNaOH和Na2CO3的混合溶液中c(Na+)为4.4mol/L,加入120ml 2mol/L稀盐酸,测得溶液中n(CO32-)和n(HCO3-)之比为2:1,计算:
(1)原混合溶液中NaOH和Na2CO3的物质的量浓度?
(2)若用甲基橙作指示剂,在滴定时,至少还需加入多少ml盐酸,才能使甲基橙变色.
(1)原混合溶液中NaOH和Na2CO3的物质的量浓度?
(2)若用甲基橙作指示剂,在滴定时,至少还需加入多少ml盐酸,才能使甲基橙变色.
考点:有关混合物反应的计算
专题:计算题
分析:反应后的溶液中存在碳酸根离子,则碳酸钠与盐酸反应没有生成二氧化碳气体,CO32-和HCO3-的物质的量之和等于原溶液中碳酸钠的物质的量;设出原溶液中碳酸钠、碳酸氢钠的物质的量分别为x、y,根据反应后的溶液中CO32-和HCO3-的物质的量之比为2:1可知反应生成碳酸氢钠的物质的量为
y,然后分别根据钠离子守恒、消耗氯化氢的总物质的量列式计算,最后根据c=
计算出原溶液中氢氧化钠、碳酸钠的浓度.
| 1 |
| 3 |
| n |
| V |
解答:
解:(1)原溶液中n(Na+)=4.4mol/L×0.1L=0.44mol,
n(HCl)=2mol/L×0.12L=0.24mol,
设原溶液中NaOH的物质的量为x、Na2CO3的物质的量为y,根据钠离子守恒可得:①x+2y=0.44,
测得溶液中CO32-和HCO3-的物质的量之比为2:1,则反应生成的碳酸氢根离子的物质的量为:y×
mol,
加入盐酸先后发生H++OH-=H2O、CO32-+H+=HCO3-,
根据消耗的氯化氢的物质的量可得:②x+
mol=0.24mol,
根据①②联立解得:x=0.2,y=0.12mol,
原溶液中氢氧化钠的物质的量浓度为:c(NaOH)=
=2mol/L,
原溶液中碳酸钠的物质的量浓度为:c(Na2CO3)=
=1.2mol/L,
答:原混合液中NaOH的浓度为2mol/L、Na2CO3的物质的量浓度为1.2mol/L;
(2)若用甲基橙作指示剂,在滴定时,要使甲基橙变色,应全部反应生成NaCl,
分别发生NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑,
0.2mol 0.2mol 0.12mol 0.24mol
共消耗HCl的物质的量为0.2mol+0.24mol=0.44mol,
则还应加入盐酸的体积为
=0.1L=100mL,
答:至少还需加入100mL盐酸,才能使甲基橙变色.
n(HCl)=2mol/L×0.12L=0.24mol,
设原溶液中NaOH的物质的量为x、Na2CO3的物质的量为y,根据钠离子守恒可得:①x+2y=0.44,
测得溶液中CO32-和HCO3-的物质的量之比为2:1,则反应生成的碳酸氢根离子的物质的量为:y×
| 1 |
| 3 |
加入盐酸先后发生H++OH-=H2O、CO32-+H+=HCO3-,
根据消耗的氯化氢的物质的量可得:②x+
| y |
| 3 |
根据①②联立解得:x=0.2,y=0.12mol,
原溶液中氢氧化钠的物质的量浓度为:c(NaOH)=
| 0.2mol |
| 0.1L |
原溶液中碳酸钠的物质的量浓度为:c(Na2CO3)=
| 0.12mol |
| 0.1L |
答:原混合液中NaOH的浓度为2mol/L、Na2CO3的物质的量浓度为1.2mol/L;
(2)若用甲基橙作指示剂,在滴定时,要使甲基橙变色,应全部反应生成NaCl,
分别发生NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑,
0.2mol 0.2mol 0.12mol 0.24mol
共消耗HCl的物质的量为0.2mol+0.24mol=0.44mol,
则还应加入盐酸的体积为
| 0.44mol-0.24mol |
| 2mol/L |
答:至少还需加入100mL盐酸,才能使甲基橙变色.
点评:本题考查了混合物反应的有关计算,题目难度中等,明确反应的先后顺序及反应产物为解答关键,注意质量守恒在化学计算中的应用方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),5min 后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的2倍,A的转化率不发生变化,则下列说法正确的是( )
| A、a=3 |
| B、a=2 |
| C、B的转化率为40% |
| D、B的转化率为60% |
能正确表示下列反应离子方程式的是( )
| A、碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-→CaCO3↓+H2O |
| B、Fe2(SO4)3的酸性溶液中通过入足量硫化氢:2Fe3++H2S→2Fe2++S↓+2H+ |
| C、浓盐酸与二氧化锰反应制氯气:MnO2+4H++2Cl-→Mn2++2H2O+Cl2↑ |
| D、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
下列关于SO2的说法中,不正确的是( )
| A、SO2能使品红溶液褪色,是因为SO2具有漂白性 |
| B、SO2在空气中极易被氧化为SO3 |
| C、SO2通入Na2SO3或NaHCO3溶液中均能发生反应 |
| D、SO2是形成酸雨的大气污染物之一,主要来自于化石燃料的燃烧和工厂排放的废气 |
下列事实不能用勒夏特列原理解释的是( )
| A、配置FeCl3溶液时加入少量浓盐酸 |
| B、加热有利于纯碱溶液去油污 |
| C、500°C比常温更有利于合成氨 |
| D、醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率 |
下列说法正确的是( )
| A、地壳中含量最多的元素是铝元素 |
| B、在自然界中钠以化合态存在 |
| C、铁在自然界中主要以铁单质的形式存在 |
| D、铁是金属元素,其单质在空气中不能燃烧 |
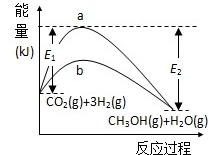 一定条件下发生反应:
一定条件下发生反应:

 、
、