题目内容
【题目】试用VSEPR理论判断下列分子或离子的立体构型,并判断中心原子的杂化类型:
(1)H2O____________形,杂化类型_________;
(2)CO32-__________形,杂化类型_________;
(3)SO32-__________形,杂化类型_________;
【答案】V形 sp3 平面三角形 sp2 三角锥形 sp3
【解析】
根据价层电子对互斥理论确定分子或离子空间构型,价层电子对个数n=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数= ![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化,据此分析解答。
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化,据此分析解答。
(1)H2O中价层电子对个数n=2+![]() (6-2×1)=4,含孤电子对数为2,中心原子采用sp3杂化,所以该分子为V型;
(6-2×1)=4,含孤电子对数为2,中心原子采用sp3杂化,所以该分子为V型;
(2)CO32-中价层电子对个数n=3+![]() (4+2-3×2)=3,含孤电子对数为0,中心原子采用sp2杂化,所以该分子为平面三角形;
(4+2-3×2)=3,含孤电子对数为0,中心原子采用sp2杂化,所以该分子为平面三角形;
(3)SO32-中价层电子对个数n=3+![]() (6+2-3×2)=4,含孤电子对数为1,中心原子采用sp3杂化,所以该分子为三角锥形。
(6+2-3×2)=4,含孤电子对数为1,中心原子采用sp3杂化,所以该分子为三角锥形。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是__。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__。
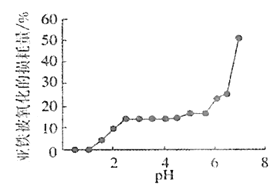
(4)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为__。(写出一条即可)
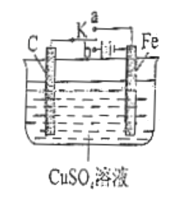
(5)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
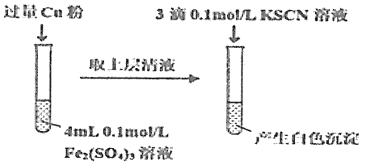
①Fe3+与Cu反应的离子方程式为__。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
实验方案 | 现象 |
步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
步骤2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为__。