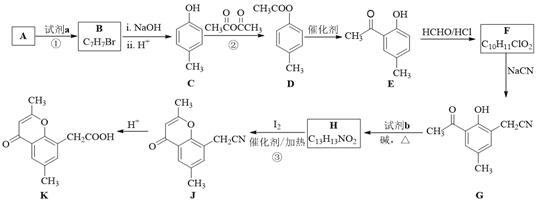
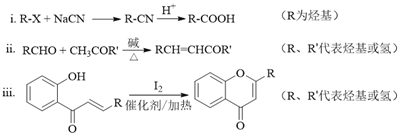��Ŀ����
����Ŀ��NOx����ɴ�����Ⱦ���ڹ�ҵ�ϲ��ö��ַ������д�����
I.�������������е�NO��O3Ԥ������ת��ΪNO2������CaSO3����Һ����NO2��
��֪�������£�CaSO4�ij����ܽ�ƽ�ⳣ����ֵΪ9.1��10-6��CaSO3�ij����ܽ�ƽ�ⳣ����ֵΪ3.1��10-7��
��1��NO��O3��Ӧ���̵������仯���£�
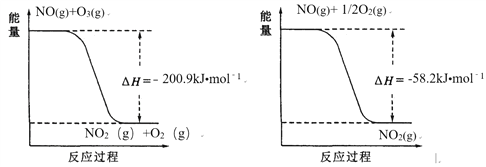
NO��O3�������ܷ�Ӧ�ǻ��Ϸ�Ӧ���÷�Ӧ���Ȼ�ѧ����ʽΪ ________��
��2����CaSO3����Һ���ã�ȡ�ϲ���Һ�����pHԼΪ8���û�ѧ���������ԭ��Ϊ________��
��3����CaSO3����Һ����NO2������ת��ΪHNO2���÷�Ӧ�Ļ�ѧ����ʽΪ________��
��4����ʵ������NO2�Ĺ����У�ͨ����CaSO3����Һ�м���Na2SO4���壬���NO2���������ʣ����ܽ�ƽ��ĽǶȽ�����ԭ����________��
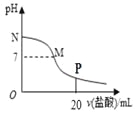
II. ѡ���ԷǴ���ԭ�����÷�Ӧ��ʹ�ô������������ڸ�������������NH3����ԭ���� NOx ����ѡ���Է�Ӧ��4NH3 + 4NO + O2 ![]() 3N2 + 6H2O����ͬ�¶ȣ�T���£���Ӧʱ�䣨t����NOŨ�ȵĹ�ϵ����ͼ��ʾ��
3N2 + 6H2O����ͬ�¶ȣ�T���£���Ӧʱ�䣨t����NOŨ�ȵĹ�ϵ����ͼ��ʾ��
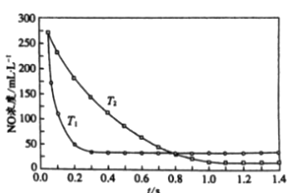
��5���жϸ÷�ӦΪ________��������������������������Ӧ��˵��������________ ��
���𰸡� 3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1 SO32- + H2O
3NO2(g) ��H= -317.3 kJmol��1 SO32- + H2O ![]() HSO3- + OH- CaSO3 + 2NO2 + H2O
HSO3- + OH- CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4 CaSO3��Һ�д�����CaSO3(s)
2HNO2 + CaSO4 CaSO3��Һ�д�����CaSO3(s) ![]() Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ� ���� ��ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ
Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ� ���� ��ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ
��������I. (1). ����ͼ��֪��NO��O3��Ӧ����NO2��O2���Ȼ�ѧ����ʽΪ��NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200.9kJ/mol ��������ͼ��֪��NO��O2��Ӧ����NO2���Ȼ�ѧ����ʽΪ��NO(g)��![]() O2(g)=NO2(g) ��H=��58.2kJ/mol ������+2���ڵ�3NO(g) + O3(g)
O2(g)=NO2(g) ��H=��58.2kJ/mol ������+2���ڵ�3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1���ʴ�Ϊ��3NO(g) + O3(g)
3NO2(g) ��H= -317.3 kJmol��1���ʴ�Ϊ��3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1��
3NO2(g) ��H= -317.3 kJmol��1��
(2). CaSO3��ǿ�������Σ�SO32������Һ�з���ˮ�ⷴӦ��SO32- + H2O ![]() HSO3- + OH-��ʹ��Һ�ʼ��ԣ��ʴ�Ϊ��SO32- + H2O
HSO3- + OH-��ʹ��Һ�ʼ��ԣ��ʴ�Ϊ��SO32- + H2O ![]() HSO3- + OH-��
HSO3- + OH-��
(3). ��CaSO3����Һ����NO2������ת��ΪHNO2����Ԫ�صĻ��ϼ۴�+4�۽��͵�+3��������Ԫ�صĻ��ϼ۴�+4�����ߵ�+6����SO32������SO42�������ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�Ļ�ѧ����ʽΪ��CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4���ʴ�Ϊ��CaSO3 + 2NO2 + H2O
2HNO2 + CaSO4���ʴ�Ϊ��CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4��
2HNO2 + CaSO4��
(4). ��CaSO3��Һ�д����ܽ�ƽ����CaSO3(s) ![]() Ca2+(aq) + SO32-(aq)
Ca2+(aq) + SO32-(aq)![]() Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ���
Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ���
II. (5). ��ͼ��֪����T1�¶��·�Ӧ�ȴﵽƽ��״̬��˵��T1>T2������ʱNO��ƽ��Ũ�ȸߣ�˵���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ʴ�Ϊ�����ȣ���ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ��

����Ŀ��
(��)ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
���������ʵ����Ʊ�������ʵ��Ŀ��һ������գ�
ʵ�� ��� | �¶� ���棩 | ����ʯ ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
�� | 25 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 (II)ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ͢�̽��______________�Է�Ӧ���ʵ�Ӱ�� |
�� | 25 | �ֿ��� | _______ | |
�� | _____ | �ֿ��� | 2.00 | |
�� | 25 | ϸ���� | 2.00 |
(��)��2.5 mol A��2.5 mol B��Ϸ���2 L�ܱ������������Ӧ��3A(g)��B(g)![]() xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
��1����ƽ��ʱB��ת����Ϊ_____________________��
��2��x��ֵΪ___________________��
��3�����¶Ȳ��䣬��ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��____________����