题目内容
高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式: 2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4。有关分析错误的是
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1 mol Na2FeO4转移3 mol电子
D.高铁酸钠的氧化性大于次氯酸钠
【答案】
CD
【解析】
试题分析:A.在体现氧化能力的过程中Na2FeO4到三价铁离子,次氯酸钠到氯离子,当等物质的量时转移的电子数Na2FeO4大于次氯酸钠的,故A正确。湿法中氢氧化铁中的铁元素化合价升高被氧化,正确。C.干法中每生成1 mol Na2FeO4应转移2 mol电子,错误。D.由2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O反应再根据氧化剂的氧化性强于氧化产物的氧化性,高铁酸钠的氧化性弱于次氯酸钠,错误。
考点:本题主要考查氧化还原反应中电子的转移及氧化性强弱判断相关知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
化学知识广泛应用于生产、生活中,下列叙述正确的是( )
| A、钢铁制品被锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 | B、海水淡化和工业生产及生活的废水再利用,是解决缺水问题的有效途径之一 | C、高铁酸钠Na2FeO4和Cl2O都能作为净水剂,其原理完全相同 | D、液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |
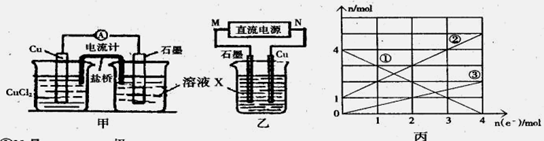

 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。 2Na2FeO4+Na2O
2Na2FeO4+Na2O