题目内容
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2 2Na2FeO4+Na2O
2Na2FeO4+Na2O
关于该反应说法正确的是
A、反应中Na2O2是氧化剂
B、Fe2O3可以通过铁丝在氧气中燃烧制得
C、生成1 mol Na2FeO4,有6 mol电子转移
D、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
【答案】
A
【解析】
试题分析:A在该反应中Na2O2作氧化剂,把Fe2O3氧化为Na2FeO4,它本身被还原为Na2O。正确。B、Fe2O3可以通过铁丝在氧气中加热制得。燃烧则产生四氧化三铁。错误。C反应前铁的化合价为+3价,反应后变为Na2FeO4中的+6价。故生成1 mol Na2FeO4,有3mol电子转移.错误。D、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌,还原产物氢氧化铁有吸附性,又可以起到净化水的作用。错误。
考点:考查高效的饮用水处理剂高铁酸钠(Na2FeO4)的制备及性质的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学知识广泛应用于生产、生活中,下列叙述正确的是( )
| A、钢铁制品被锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 | B、海水淡化和工业生产及生活的废水再利用,是解决缺水问题的有效途径之一 | C、高铁酸钠Na2FeO4和Cl2O都能作为净水剂,其原理完全相同 | D、液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |
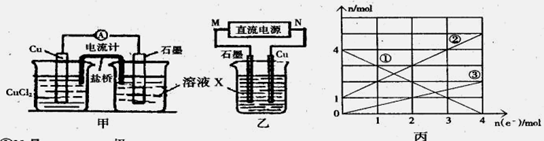

 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。