题目内容
1.下列有关冶炼金属的说法正确的是( )| A. | 工业上冶炼钠,是通过电解氯化钠饱和溶液 | |
| B. | 工业上冶炼铝,如果以石墨为电极,则阳极石墨需要不断补充 | |
| C. | 工业上冶炼镁,是电解熔融氧化镁 | |
| D. | 工业上精炼铜是粗铜为阴极 |
分析 根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,较活泼金属用热还原法,不活泼金属如Hg、Ag等用热分解法冶炼,据此解答.
解答 解:A.钠性质活泼,工业上用电解熔融氯化钠方法制取,故A错误;
B.铝性质活泼,工业上用石墨做电解质熔融氧化铝方法制取,阳极上生产氧气,氧气与石墨反应,消耗石墨,所以需要不断补充石墨,故B正确;
C.镁性质活泼,工业上用电解熔融氯化镁方法制取,故C错误;
D.工业上精炼铜是粗铜为阳极,精铜做阴极,故D错误;
故选:B.
点评 本题考查了金属的冶炼,熟悉金属性质的活泼性,明确不同活泼性金属的冶炼方法是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
①木材纤维和土豆淀粉遇碘水均显蓝色
②食用花生油和鸡蛋清都能发生水解反应
③包装用材料聚乙烯和聚氯乙烯都属于烃
④PX项目的主要产品对二甲苯属于芳香烃
⑤金属钠着火时使用泡沫灭火器灭火
⑥用试管加热碳酸氢钠固体时使试管呈四十五度倾斜
⑦浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
⑧制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片.
①木材纤维和土豆淀粉遇碘水均显蓝色
②食用花生油和鸡蛋清都能发生水解反应
③包装用材料聚乙烯和聚氯乙烯都属于烃
④PX项目的主要产品对二甲苯属于芳香烃
⑤金属钠着火时使用泡沫灭火器灭火
⑥用试管加热碳酸氢钠固体时使试管呈四十五度倾斜
⑦浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
⑧制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片.
| A. | ①④⑥ | B. | ②⑤⑦ | C. | ②④⑧ | D. | ①⑦⑧ |
6.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCI | CO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCI2 |
| ④ | CO2 | NH3 | CaCI2 |
| A. | ②④ | B. | ① | C. | ①③ | D. | ④ |
13.可以验证硫元素的非金属性比氯元素弱的事实是( )
①H2S溶于水是弱酸,HC1溶于水是强酸②向氢硫酸溶液中通入氯气有单质硫生成
③还原性:S2->Cl- ④高氯酸(HCl04)的酸性比硫酸强.
①H2S溶于水是弱酸,HC1溶于水是强酸②向氢硫酸溶液中通入氯气有单质硫生成
③还原性:S2->Cl- ④高氯酸(HCl04)的酸性比硫酸强.
| A. | ①②④ | B. | ②④ | C. | ②③④ | D. | ①②③④ |
10.2015年9月24日双鸭山市区发生严重的雾霾天气,对人们的健康造成严重威胁,环境问题离我们也并不遥远了,则下列有关环境问题说法正确的是( )
| A. | PH<7的雨水称为酸雨 | |
| B. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生相关 | |
| D. | SO2、CO2、NO2均属于大气污染物 |
11.下列离子方程式正确的是( )
| A. | 硫酸钠溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 大理石与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| D. | 氯化镁容液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
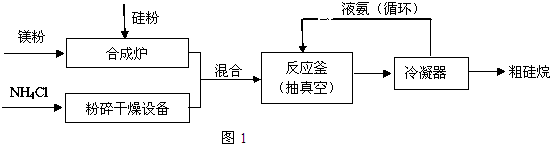
 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.