题目内容
下列各组离子因发生氧化还原反应而不能大量共存的是( )
A、Ba2+、Cl-、C
| ||||
B、N
| ||||
C、Na+、H+、S
| ||||
D、Fe2+、H+、N
|
考点:离子共存问题,氧化还原反应
专题:离子反应专题
分析:离子之间发生氧化还原反应,则溶液中应存在强氧化性和强还原性离子,且能发生氧化还原反应,以此解答.
解答:
解:A.B2+a与CO32-反应生成沉淀,不是氧化还原反应,故A不选;
B.Mg2+与OH-反应生成沉淀、NH4+与OH-反应生成一水合氨,不是氧化还原反应,故B不选;
C.H+与SO32-发生生成二氧化硫和水,不是氧化还原反应,故C不选;
D.酸性条件下,Fe2+与NO3-、发生氧化还原反应而不能大量共存,故D选.
故选D.
B.Mg2+与OH-反应生成沉淀、NH4+与OH-反应生成一水合氨,不是氧化还原反应,故B不选;
C.H+与SO32-发生生成二氧化硫和水,不是氧化还原反应,故C不选;
D.酸性条件下,Fe2+与NO3-、发生氧化还原反应而不能大量共存,故D选.
故选D.
点评:本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握离子的性质以及反应类型的判断,注意题目氧化还原反应的要求,难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列表示错误的是( )
| A、1mol O |
| B、1mol氧 |
| C、1mol O2- |
| D、1mol O2 |
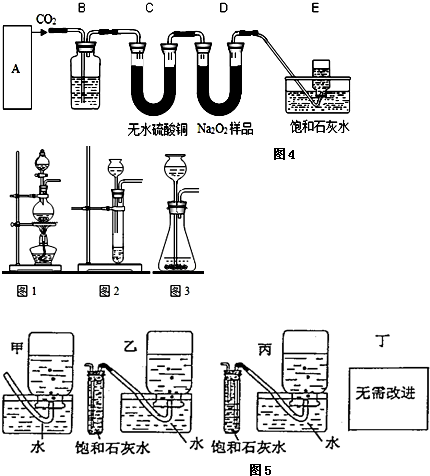
利用下列实验装置完成相应的实验,能达到实验目的是( )
A、 除去CO2中的HCl气体 |
B、 铁的析氢腐蚀 |
C、 制备并收集少量NO2气体 |
D、 转移溶液 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氮原子的氮气在标准状况下的体积约为22.4 L |
| B、标准状况下,11.2 L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2 L Cl2含有的分子数为0.5NA |
| D、25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA |
新能源又称非常规能源.是指传统能源之外的各种能源形式.指刚开始开发利用或正在积极研究、有待推广的能源,如太阳能、地热能、风能、海洋能、生物质能和核聚变能等.下列有关新能源的说法不正确的是( )
| A、新能源与化石能源相比最直接的好处就是环境污染少 |
| B、利用晶体硅制作的太阳能电池可将太阳能直接转换为电能,实现太阳能的利用 |
| C、氢能是一种清洁的二次能源.可用电解水制氢的方法获取大量氢气实现能源的绿色化 |
| D、解决能源危机的方法是开源节流,即开发新能源和节约现有能源,提高原料的利用率 |
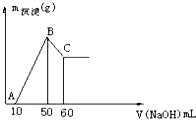 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,下列叙述不正确的是( )| A、盐酸的物质的量浓度为0.5mol?L-1 |
| B、合金中铝的物质的量为0.01mol |
| C、合金中镁的物质的量为0.005mol |
| D、B点与C点沉淀的物质的量之比为2:1 |
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C、增大压强,可使单位体积内活化分子数百分数增多,反应速率加快 |
| D、催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |