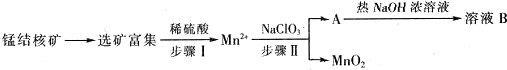题目内容
在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g)?pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
| A、体系压强不再发生变化 |
| B、各组分的物质的量浓度不再改变 |
| C、各组分的质量分数不再改变 |
| D、反应速率vA:vB:vC:vD=m:m:p:q |
考点:化学平衡状态的判断
专题:
分析:化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答:
解:A.若反应前后气体的体积不变,则体系压强不再发生变化不能作为判断是否达到化学平衡状态的依据,故A错误;
B.各组分的物质的量浓度不再改变,是平衡的标志,故B正确,
C.各组分质量分数不变,说明各组分浓度不变,反应达到平衡状态,故C正确;
D.反应速率之比等于化学计量数之比,故反应速率vA:vB:vC:vD=m:n:p:q不能作为判断是否达到化学平衡状态的依据,故D错误;
故选BC.
B.各组分的物质的量浓度不再改变,是平衡的标志,故B正确,
C.各组分质量分数不变,说明各组分浓度不变,反应达到平衡状态,故C正确;
D.反应速率之比等于化学计量数之比,故反应速率vA:vB:vC:vD=m:n:p:q不能作为判断是否达到化学平衡状态的依据,故D错误;
故选BC.
点评:本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
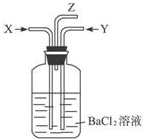
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
下列离子方程式书写正确的是( )
A、用电极电解少量的MgCl2溶液:2H2O+2Cl-
| ||||
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率随时间的变化如图所示:下列说法中正确的是( )


| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素中子数与核外电子数之差是( )
| A、57 | B、47 | C、64 | D、293 |
芳香烃是指( )
| A、分子里含有苯环的化合物 |
| B、分子组成符合CnH2n-6 通式的一类有机物 |
| C、分子里含有一个或多个苯环的烃 |
| D、苯和苯的同系物的总称 |
 已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:
已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题: