题目内容
向①少量MgCl2溶液②少量AlCl3溶液中都分别先加入少量、再加入过量的NaOH溶液,振荡(1)观察到的现象分别是① ,② 。(2)有关离子方程式是① ② (3)由上述现象可得到的结论是 ,碱性顺序Mg(OH)2 Al(OH)3,金属性顺序Mg Al。
答案:
解析:
提示:
解析:
(1)①产生白色沉淀;②产生白色沉淀后又逐渐溶解 (2)①Mg2++2OH-=Mg(OH)2↓②Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O (3)Mg(OH)2不与NaOH反应,而Al(OH)3与NaOH反应生成NaAlO2和水,说明Mg(OH)2无酸性,而Al(OH)3具有一定酸的性质。碱性Mg(OH)2>Al(OH)3,金属性顺序Mg>Al。
|
提示:
此题意在通过比较Mg2+、Al3+与过量OH-混合的不同现象,比较Mg(OH)2与Al(OH)3 “酸性”的差异,反推出碱性Mg(OH)2>Al(OH)3,再结合元素周期律的知识,元素最高价氧化物水化物的碱性越强,其金属性越强,最终得出金属性Mg>Al的结论。既考查Mg(OH)2、Al(OH)3与碱的反应,又考查由实验事实判断推出性质规律、验证元素周期律知识的能力。
|

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
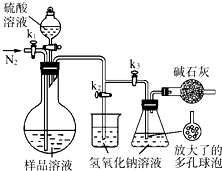 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: