题目内容
18.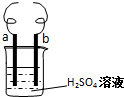 用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.
用电极a(铁丝)、电极b(铜丝)和H2SO4溶液可以构成原电池或电解池,如图所示.(1)如果a、b直接相连则构成原电池,此时b极为:正极,溶液中的H+移向b极(填“a”或“b”),当电路中通过0.1mol电子时,则生成H21.12L(标准状况下);
(2)如果将a、b分别换成石墨,H2SO4溶液换成饱和氯化铜溶液,a、b分别与直流电源的正、负极相连时,则b极为阴极,电极反应为Cu2++2e-=Cu.该反应中发生的能量转化形式是电能转化为化学能.
分析 构成原电池时,较活泼的金属铁作负极,负极上金属失电子发生氧化反应,较不活泼的金属铜作正极,正极上得电子发生还原反应,氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,构成电解池时,阳极上金属电极失电子发生氧化反应,阴极上铜离子得电子发生还原反应.由此分析解答.
解答 解:(1)如果a、b直接相连则构成原电池,此时b极铜不活泼,为正极,溶液中的H+移向正极b移动,当电路中通过0.1mol电子时,则生成H2 的物质的量为0.05mol,所以标准状况下生成1.12L,故答案为:原电池; 正;b;1.12;
(2)负极相连的为阴极,则b极为阴极,电极反应为 Cu2++2e-=Cu,该反应中发生的能量转化形式是电能转化为化学能,故答案为:阴; Cu2++2e-=Cu;电能转化为化学能.
点评 本题考查了原电池和电解池工作原理,难度不大,明确离子的放电顺序是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6. 金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )
 金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )| A. | 绿原酸分子中有4个手性碳原子(碳旁边连接4个不同的原子或原子团) | |
| B. | 绿原酸能发生显色反应、取代反应和加成反应 | |
| C. | 每摩尔绿原酸最多与4 mol NaOH反应 | |
| D. | 绿原酸分子中所有碳原子都能在同一平面上 |
13.下列说法正确的是( )
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 | |
| D. | 石油裂化的主要目的是为了提高轻质油的质量和产量 |
3.现有如下各种说法,正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属元素的原子和非金属元素的原子化合均形成离子键
③离子键是阴、阳离子的相互吸引力
④根据电离方程式HCl═H++Cl-,判断HCl分子中存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子中共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
①在水中氢、氧原子间均以化学键相结合
②金属元素的原子和非金属元素的原子化合均形成离子键
③离子键是阴、阳离子的相互吸引力
④根据电离方程式HCl═H++Cl-,判断HCl分子中存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子中共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程.
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
10. 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 其分子式为C15H20O4 | |
| B. | 该物质含三种官能团 | |
| C. | 能发生加成反应、取代反应、氧化反应、酯化反应、加聚反应 | |
| D. | 1mol该物质与足量NaOH溶液反应,最多消耗1molNaOH |
7. 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氰化物的稳定性庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物对应水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
8.下列属于同位素的是( )
| A. | 镁条镁粉 | B. | 氧化钠过氧化钠 | C. | 氕氘氚 | D. | C60石墨 |
