题目内容
7.如图是找国科技工作者研制的以尿素为原料生产三聚氰胺(C3N6H6)的工艺--“常压气相一步法联产纯玻新技术”: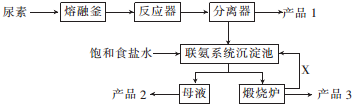
已知:①尿素的熔点是132.7℃,常压下超过160℃即可分解;②三聚氰胺的熔点是354℃,加热易升华,微溶于水.
请回答下列问题:
(1)以尿素为原料生产三聚氮胺的原理是6CO(NH2)2$\stackrel{一定条件}{→}$1C3N6H6+6NH3↑+3CO2↑(配平化学方程式,在横线上填上相应物质的化学计量数),在实验室使尿素熔化的容器的名称为坩埚.
(2)写出下列物质中主要成分的化学式:产品2NH4Cl、XCO2.
(3)联氨系统沉淀池中发生反应的化学方程式为CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3.
(4)为了使母液中析出更多的产品2,常用的方法是AC;
A.加人NaCl固体 B.加入NaHCO3固体 C.通人CO2 D.通人NH3.
分析 尿素的熔点是132.7℃,常压下超过160℃即可分解,三聚氰胺的熔点是354℃,加热易升华,微溶于水,尿素在一定条件下分解生成三聚氰胺和氨气、二氧化碳,饱和食盐水加入联氨系统沉淀池,所以产品1为三聚氰胺;从联氨系统沉淀池中得到的母液中含有氯化铵,得到的沉淀是碳酸氢钠,煅烧碳酸氢钠得到二氧化碳,所以产品2是NH4Cl、产品3是Na2CO3、X是CO2,
(1)根据原子守恒配平方程式;在实验室使尿素熔化的容器的名称是坩埚;
(2)产品2是铵盐,X是二氧化碳;
(3)联氨系统沉淀池中发生反应生成氯化铵和碳酸氢钠;
(4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以增大反应物浓度.
解答 解:尿素的熔点是132.7℃,常压下超过160℃即可分解,三聚氰胺的熔点是354℃,加热易升华,微溶于水,尿素在一定条件下分解生成三聚氰胺和氨气、二氧化碳,饱和食盐水加入联氨系统沉淀池,所以产品1为三聚氰胺;从联氨系统沉淀池中得到的母液中含有氯化铵,得到的沉淀是碳酸氢钠,煅烧碳酸氢钠得到二氧化碳,所以产品2是NH4Cl、产品3是Na2CO3、X是CO2,
(1)根据原子守恒配平方程式为6CO(NH2)2$\stackrel{一定条件}{→}$ C3N6H6+6NH3↑+3CO2↑,在实验室使尿素熔化的容器的名称是坩埚,故答案为:6;1;6;3;坩埚;
(2)通过以上分析知,产品2是NH4Cl,X是CO2,故答案为:NH4Cl;CO2;
(3)联氨系统沉淀池中发生反应生成氯化铵和碳酸氢钠,反应方程式为CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3,故答案为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3;
(4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以增大反应物浓度,所以可以向溶液中加入氯化钠或者通入二氧化碳气体,
故选AC.
点评 本题考查物质制备,为高频考点,明确流程图中发生的反应及实验基本操作方法是解本题关键,熟悉氨碱法制备原理,题目难度不大.

| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
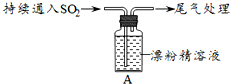 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰;
②由实验a、b不能判断白雾中含有HCl,理由是白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
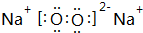
(2)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式
 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.(3)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反 应的离子方程式:Al(OH)3+3H+=Al3++3H2O,Al(OH)3+OH-=AlO2-+2H2O.
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱.Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为AB.
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3.
| A. | 金属铝投入到氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
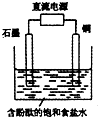
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
| A. | 1molHCl | B. | 3.01×1023个O2 | C. | 12g12C | D. | 0.5molCH4 |
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
