题目内容
17.短周期主族元素X、Y、Z、W在元素周期表中的位置如图所示,其中X元素原子的最外层电子数是其次外层电子数的3倍,下列说法不正确的是( )| X | |||
| Y | Z | W |
| A. | 原子半径:Y>Z>X | |
| B. | 化合物YX2和ZX2含有的化学键类型相同 | |
| C. | Z元素的氧化物对应水化物的酸性一定比W的弱 | |
| D. | Y、W元素能形成化学式为YW4的化合物 |
分析 由短周期主族元素X、Y、Z、W在元素周期表中的位置可知,X位于第二周期,X元素原子的最外层电子数是其次外层电子数的3倍,可知最外层电子数为6,则X为O元素,结合元素在周期表的位置可知,Z为S,W为Cl,Y为Si,以此来解答.
解答 解:由上述分析可知,X为O,Y为Si,Z为S,W为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y>Z>X,故A正确;
B.化合物SiO2只含Si-O共价键,SO2含S-O共价键,故B正确;
C.非金属性Cl>S,则Z元素的最高价氧化物对应水化物的酸性一定比W的弱,但硫酸的酸性大于HClO的酸性,故C错误;
D.Si的最高正价为+4价,Cl的最低价为-1价,则能形成化学式为YW4的化合物,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
8.下列过程与配合物的形成无关的是( )
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向FeCl3溶液中加入KSCN溶液 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向硫酸铝溶液中加入氨水 |
5.下列仪器属于容量瓶的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列有关Cl2的说法中,不正确的是( )
| A. | Cl2是一种黄绿色的有毒气体 | B. | 红热的铁丝在Cl2中燃烧生成FeCl2 | ||
| C. | 工业上用Cl2和石灰乳制造溧白粉 | D. | 新制氯水应避光保存 |
2.下列说法不正确的是( )
| A. | 碘晶体升华,只需克服碘单质分子间的作用力 | |
| B. | 冰、干冰、水晶中的化学键类型相同,都属于分子晶体 | |
| C. | N2和CS2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 氢氧化钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性 |
9.下列说法正确的是( )
| A. | 碘酒能使蛋白质发生变性 | |
| B. | 化工合成的香精均可用作食品添加剂 | |
| C. | 司母戊鼎的主要成分为铁 | |
| D. | 铵态氮肥与草木灰混合使用效果更好 |
6.用60g乙酸与92g乙醇的反应,实际得到乙酸乙酯的质量为52.8g,本实验的产率是( )
| A. | 30% | B. | 40% | C. | 60% | D. | 90% |
7.某有机物的结构简式如图所示,则此有机物可发生反应的类型有( )

①取代反应 ②加成反应 ③消去反应 ④酯化反应⑤水解反应 ⑥氧化反应⑦中和反应.

①取代反应 ②加成反应 ③消去反应 ④酯化反应⑤水解反应 ⑥氧化反应⑦中和反应.
| A. | ①②③④⑤⑥⑦ | B. | ②③④⑤⑥ | C. | ②③④⑤⑥⑦ | D. | ①②③⑤⑥ |

 ;这样制取的溴苯可以用AD洗涤除Br2.
;这样制取的溴苯可以用AD洗涤除Br2.

 FeBr3+
FeBr3+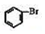 +HBr;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是有水情况下,无法生成Br+.
+HBr;该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能的原因是有水情况下,无法生成Br+.