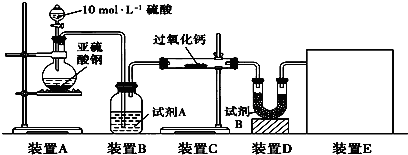
题目内容
过氧化钙(CaO2)是一种安全无毒物质,带有结晶水,通常还含有CaO。
(1)称取0.542 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]![]() 2CaO+O2↑+2xH2O,得到O2在标准状态下体积为67.2 mL,该样品中CaO2的物质的量为______。
2CaO+O2↑+2xH2O,得到O2在标准状态下体积为67.2 mL,该样品中CaO2的物质的量为______。
(2)另取同一样品0.542 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70 g。
①试计算样品中CaO的质量。
②试计算样品中CaO2·xH2O的x值。
解析:(1)n(CaO2)=n(CaO2·4H2O)=2·n(O2)=2×67.2 mL/22400 mL·mol-1=0.006 mol.
(2)①n(Ca2+)总=n(CaCO3)=0.70 g÷100 g/mol=0.007 mol
m(CaO)原=(0.007 mol-0.006 mol)×56 g·mol-1=0.056 g
②x= 0.542 g-0.056 g-0.006 mol×72 g/mol/18 g/mol ÷0.006 mol= 1/2 。
答案:(1)0.006 mol(2)①0.056 g②x= 1/2

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目



 CaO2+2HCl
CaO2+2HCl