题目内容
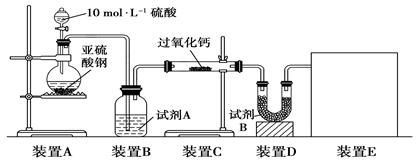
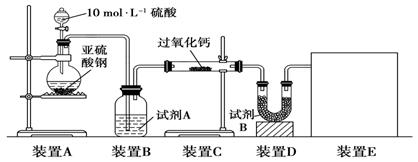
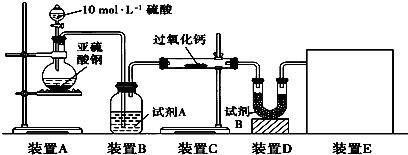
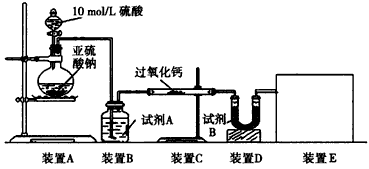
面粉增白剂主要包括过氧化苯甲酰(俗称面粉增白剂)和过氧化钙两种物质.其中过氧化钙(CaO2)在日常生活和工农业生产中还常用于种子消毒、药物制造、油脂漂白及鱼池增氧等,还可以作为高温氧化剂.已知:过氧化钙与CO2反应有气体生成,而将SO2通入过氧化钙粉末中也有气体生成.有人提出CO2、SO2与过氧化钙的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.实验一:通过测量气体的体积判断发生的化学反应,实验装置如下:
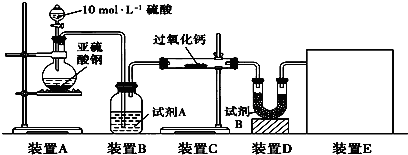
(1)试剂A可以选用
(2)装置E用于测定氧气的体积,请在方框中画出装置图.
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、部分被氧化、完全被氧化的V-m1关系式.
未被氧化:
若SO2完全被氧化,写出反应的化学方程式:
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点.
提出假设:
假设1:反应后固体只有
假设2:反应后固体中只有
假设3:
实验探究:
(4)设计实验,证明假设3是正确的,简要回答实验过程、现象和结论:
实验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:
分析:实验一:(1)过氧化钙和水反应,装置B中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种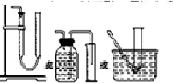
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
m1g
V=
L
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0
若0<V<
,则二氧化硫部分被氧化;
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种

(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
| VL |
| 22.4L/L |
V=
| 7m1 |
| 30 |
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0
若0<V<
| 7m1 |
| 30 |
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
解答:解:实验一:(1)过氧化钙和水反应,装置B中试剂能吸收水蒸气,所以试剂为浓硫酸,干燥气体除去水蒸气;故答案为:浓硫酸 吸收水蒸气干燥气体;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种 ,
,
故答案为: ;
;
(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
m1g
V=
L
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0
若0<V<
,则二氧化硫部分被氧化;
故答案为:
;0<V<
;0
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
故答案为:Na2SO3;Na2SO4;固体为Na2SO3和Na2SO4的混合物;
(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
故答案为:若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
(2)测定氧气的体积利用排水量气法:装置为以下几种装置中的一种
 ,
,故答案为:
 ;
;(3)实验测得装置C中过氧化钙质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),若SO2未被氧化、则发生反应:2CaO2+2SO2=2CaSO3+O2
依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 反应增重
1mol 96g
| VL |
| 22.4L/L |
V=
| 7m1 |
| 30 |
若二氧化硫全部被氧化发生的反应为:CaO2+SO2=CaSO4;反应过程中 无氧气生成,V=0
若0<V<
| 7m1 |
| 30 |
故答案为:
| 7m1 |
| 30 |
| 7m1 |
| 30 |
实验二:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究
假设1:反应后固体只有 Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3:固体为Na2SO3和Na2SO4的混合物;
故答案为:Na2SO3;Na2SO4;固体为Na2SO3和Na2SO4的混合物;
(4)证明假设3是正确的,实验设计为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
故答案为:取反应后的固体放入试管中,加少量的水溶解,加入氯化钡溶液有白色沉淀生成,再加入稀盐酸沉淀部分溶解,证明原固体中即有亚硫酸钠也有硫酸钠,即过氧化钠部分氧化二氧化硫.
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
故答案为:若剩余过氧化钠,固体加水溶解时,过氧化钠能将亚硫酸钠氧化为硫酸钠,检验出的硫酸根离子不能确定是过氧化钠和二氧化硫反应生成的;
点评:本题考查了二氧化硫性质应用和实验验证,实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断,题目较难.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目