题目内容
已知25℃时0.1mol?L-1醋酸溶液的pH约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.(已知:25℃时,0.1mol?L-1氨水的电离程度与此温度下0.1mol?L-1醋酸的电离程度相等)
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol?L-1的醋酸溶液中加入少量下列物质 (填写编号),然后测定溶液的pH.
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)根据(1)的操作,若甲的解释正确,则溶液的pH应 ;若乙的解释正确,则溶液的pH应 (填“增大”、“减小”或“不变”).
(3)你认为上述两种解释中 (填“甲”或“乙”)正确.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol?L-1的醋酸溶液中加入少量下列物质
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)根据(1)的操作,若甲的解释正确,则溶液的pH应
(3)你认为上述两种解释中
考点:弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:(1)CH3COONH4溶液呈中性,而其它三种溶液都呈碱性;
(2)CH3COONH4溶液呈中性,加入CH3COONH4,如pH变化,则乙正确;
(3)据影响弱电解质的电离平衡的因素分析.
(2)CH3COONH4溶液呈中性,加入CH3COONH4,如pH变化,则乙正确;
(3)据影响弱电解质的电离平衡的因素分析.
解答:
解:(1)CH3COONH4溶液呈中性,加入CH3COONH4,而其它三种溶液都呈碱性,不能判断甲乙两同学的解释是否正确,
故答案为:B;
(2)CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使[H+]减小,
故答案为:不变;增大;
(3)上述两种解释中,乙正确,故答案为:乙.
故答案为:B;
(2)CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使[H+]减小,
故答案为:不变;增大;
(3)上述两种解释中,乙正确,故答案为:乙.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,题目难度中等.

练习册系列答案
相关题目
下列实验可达到实验目的是( )
A、将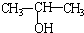 与NaOH的醇溶液共热制备CH3-CH═CH2 与NaOH的醇溶液共热制备CH3-CH═CH2 |
B、乙酰水杨酸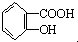 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备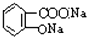 |
| C、向CH3CH2Br中滴入AgNO3溶液以检验溴元素 |
| D、甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 |
下列各组离子中,在溶液中能大量共存的是( )
| A、HCO3-、Cl-、Na+、H+ |
| B、Al3+、K+、OH-、SO42- |
| C、Fe2+、NO3-、SO42-、H+ |
| D、K+、Al3+、SO42-、NO3- |
下列说法正确的是( )
| A、一定温度下,当弱酸的浓度相同时,电离常数越大,酸性越强 |
| B、合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同 |
| C、实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔相同 |
| D、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
下列事实中,不能用勒夏特列原理解释的是( )
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、由H2(g)、I2(g)、HI(g)组成的平衡体系,压缩容器体积后颜色加深 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用适当过量的空气以提高二氧化硫的利用率 |
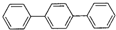 它的分子式为
它的分子式为