题目内容
10.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 1mol氖气中含有的原子数目为NA | |
| B. | 5.85g NaCl中含有的最外层电子数目为1.6NA | |
| C. | 2mol NO和1mol O2混合,充分反应后转移的电子数目为4NA | |
| D. | 25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目小于0.1NA |
分析 A.氖气为单原子分子;
B.1mol钠离子最外层8mol电子,1mol氯离子最外层8mol电子;
C.2mol NO和1mol O2混合反应生成2mol二氧化氮,转移4mol电子;
D.硫离子水解生成硫氢根离子和氢氧根离子.
解答 解:A.1mol氖气中含有的原子数目为NA,故A正确;
B.5.85g NaCl物质的量为:$\frac{5.85g}{58.5g/mol}$=0.1mol,含有的最外层电子数目为16NA,故B正确;
C.2mol NO和1mol O2混合反应生成2mol二氧化氮,转移4mol电子,转移的电子数目为4NA,故C正确;
D.25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目大于0.1NA,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数应用及有关计算,掌握以物质的量量为核心的计算公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
20.下列有关浓硝酸的说法中错误的是( )
| A. | 浓HNO3能与碳反应,说明其具有强氧化性 | |
| B. | 浓HNO3能溶解金属铜,说明其具有强酸性 | |
| C. | 浓HNO3不稳定易分解,需要避光保存 | |
| D. | 常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3 |
1.下列操作错误的是( )
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置温度计要插入加热的水中
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗上的小孔
④振荡分液漏斗中的溶液时,要一只手按住口部,另一只手握住活塞部分颠倒振荡
⑤容量瓶的刻度线上方有水珠未干燥就开始配制溶液
⑥实验室制取氯气时,为了防止环境污染,多余的氯气可以用稀氢氧化钙溶液吸收.
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置温度计要插入加热的水中
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗上的小孔
④振荡分液漏斗中的溶液时,要一只手按住口部,另一只手握住活塞部分颠倒振荡
⑤容量瓶的刻度线上方有水珠未干燥就开始配制溶液
⑥实验室制取氯气时,为了防止环境污染,多余的氯气可以用稀氢氧化钙溶液吸收.
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ③⑤⑥ |
18.某有机物X的结构筒式如图所示,下列有关说法错误的是( )
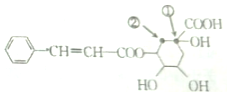

| A. | X分子中含有三种含氧官能团 | |
| B. | 若X中加入溴的四氯化碳溶液或酸性高锰酸钾溶液均褪色,则证明X分子中一定含有碳碳双键 | |
| C. | X能发生加成反应、取代反应、氧化反应和加聚反应 | |
| D. | 将①处碳原子上的-OH转移到②处碳原子上得到的有机物与X互为同分异构体 |
5.W、X、Y、Z均为短周期主族原子,原子序数依次增大,其原子的最外层电子数之和为18,W和Y同主族,X原子的电子层数与最外层电子数相等,Z元素最高正价与最低负价的绝对值之差为6,下列说法不正确的是( )
| A. | W的一种单质的沸点比X的高 | |
| B. | 氧化物的水化物的酸性:Z>W | |
| C. | W与Y可形成一种硬度很大的化合物 | |
| D. | W、X、Y三种元素均可以与Z元素形成共价化合物 |
12.下列关于过滤的叙述正确的是( )
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
10.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图1中选择称量NaOH固体所需要的仪器是(填字母):abe.
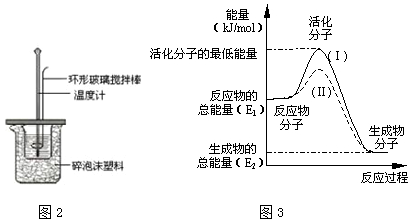
Ⅱ.测定中和热的实验装置如图2所示.
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol(中和热数值为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察3图,然后回答问题.
①图中所示反应是放热(填“吸热”或“放热”)反应,该反应的△H=(E2-E1)kJ/mol(用含E1、E2的代数式表示).
②对于同一反应,图3中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是使用了催化剂.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从图1中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol(中和热数值为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察3图,然后回答问题.
①图中所示反应是放热(填“吸热”或“放热”)反应,该反应的△H=(E2-E1)kJ/mol(用含E1、E2的代数式表示).
②对于同一反应,图3中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是使用了催化剂.