题目内容
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3、Na2CO3同时倒入试管中,观察.反应方程式:NaHCO3+HCl═NaCl+H2O+CO2↑Na2CO3+2HCl═2NaCl+H2O+CO2↑
①两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量)
②甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲下结论的方法是否正确
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做了3次平行实验,取平均值)
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 23.0℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 35mL稀盐酸 | 含3.2gNa2CO3的饱和溶液15mL水 | 20℃ | 20.6℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 23.5℃ |
①该研究报告的题目是《
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为
a:NaHCO3的溶解是
b:Na2CO3的饱和溶液和盐酸的反应是
分析:(1)①盐酸均足量,则0.3g NaHCO3、0.3g Na2CO3粉末均完全反应;
②物质溶解吸热,会使温度降低;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;
②测量温度需要温度计、称量固体需要托盘天平;
a.由实验①的温度降低可知吸收热量;
b.由实验④可知反应后温度升高.
②物质溶解吸热,会使温度降低;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;
②测量温度需要温度计、称量固体需要托盘天平;
a.由实验①的温度降低可知吸收热量;
b.由实验④可知反应后温度升高.
解答:解:(1)①盐酸均足量,则0.3g NaHCO3、0.3g Na2CO3粉末均完全反应,则生成气体的体积比=物质的量之比=
:
=53:42,故答案为:53:42;
②因物质溶解吸热,会使温度降低,则结论不正确,故答案为:不正确;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应,则该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究,
故答案为:碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究;
②测量温度需要温度计、称量固体需要托盘天平,故答案为:温度计;托盘天平;
a.由实验①的温度降低可知吸收热量,则NaHCO3的溶解是吸热过程,故答案为:吸热;
b.由实验④可知反应后温度升高,则Na2CO3的饱和溶液和盐酸的反应是放热反应,故答案为:放热.
| 0.3g |
| 84g/mol |
| 0.3g |
| 106g/mol |
②因物质溶解吸热,会使温度降低,则结论不正确,故答案为:不正确;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应,则该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究,
故答案为:碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究;
②测量温度需要温度计、称量固体需要托盘天平,故答案为:温度计;托盘天平;
a.由实验①的温度降低可知吸收热量,则NaHCO3的溶解是吸热过程,故答案为:吸热;
b.由实验④可知反应后温度升高,则Na2CO3的饱和溶液和盐酸的反应是放热反应,故答案为:放热.
点评:本题以实验探究考查碳酸钠、碳酸氢钠的性质及与酸反应的热效应,把握表格中实验数据的分析为解答的关键,注意变量控制法的应用,题目难度中等.

练习册系列答案
相关题目
某研究性学习小组对铝热反应实验展开研究.某高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是______,反应的离子方程式为______.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是______(填序号).
A.浓硫酸B.稀硫酸C.稀硝酸D.氢氧化钠溶液
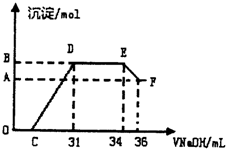
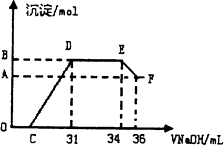
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上这的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如右图所示,试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______.
(2)在DE段,沉淀的物质的最没有变化,则此阶段发生反应的离子方程式为______,上述现象说明溶液中的离子结合OH-的能力最强的是______最弱的是______(填离子符号)
(3)B与A的差值为______mol.
某研究性学习小组对铝热反应实验展开研究.某高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的溶点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答 (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,反应的离子方程式为 .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号).
A.浓硫酸B.稀硫酸C.稀硝酸D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上这的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如右图所示,试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(2)在DE段,沉淀的物质的最没有变化,则此阶段发生反应的离子方程式为 ,上述现象说明溶液中的离子结合OH-的能力最强的是 最弱的是 (填离子符号)
(3)B与A的差值为 mol.

| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,反应的离子方程式为 .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号).
A.浓硫酸B.稀硫酸C.稀硝酸D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上这的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如右图所示,试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(2)在DE段,沉淀的物质的最没有变化,则此阶段发生反应的离子方程式为 ,上述现象说明溶液中的离子结合OH-的能力最强的是 最弱的是 (填离子符号)
(3)B与A的差值为 mol.