题目内容
为探究亚硫酸钠的热稳定性及有关性质,某研究性学习小组查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.该小组将无水亚硫酸钠隔绝空气加热,并对受热后剩余固体进行探究.
(1)提出假设:
假设1:Na2SO3未分解
假设2:Na2SO3完全分解
假设3:
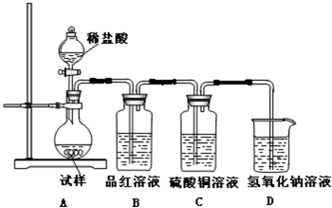
(2)设计实验方案,进行实验,该学习小组取一定量受热后的固体试样在如图所示的实验装置进行实验.请回答下列有关问题:
①A装置的气密性检查方法: ;
②如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;设反应完全,此时在B、C两装置中可能观察到得现象为 .根据实验现象,则假设成立.
③在步骤②中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子.为检验该阴离子,则实验方法为 .
④写出固体加热到600℃以上分解的化学方程式 .

(1)提出假设:
假设1:Na2SO3未分解
假设2:Na2SO3完全分解
假设3:
(2)设计实验方案,进行实验,该学习小组取一定量受热后的固体试样在如图所示的实验装置进行实验.请回答下列有关问题:
①A装置的气密性检查方法:
②如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为
③在步骤②中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子.为检验该阴离子,则实验方法为
④写出固体加热到600℃以上分解的化学方程式
考点:性质实验方案的设计,含硫物质的性质及综合应用
专题:氧族元素
分析:(1)根据假设,亚硫酸钠未分解、完全分解,则第3种情况为部分分解;
(2)①依据装置密闭后气泡冒出和液面变化分析判断装置气密性;
②SO32-、S2-可在酸性条件下转化为单质硫;则发生SO32-+2S2-+6H+=3S↓+3H2O;气体可能为二氧化硫或硫化氢气体;
③亚硫酸钠分解产物中含有硫化钠,根据硫元素的化合价变化可知,另一种产物中硫元素的化合价升高,为硫酸钠;
③由③分析可知Na2SO3固体加热到600℃以上分解产物是Na2SO4和Na2S.
(2)①依据装置密闭后气泡冒出和液面变化分析判断装置气密性;
②SO32-、S2-可在酸性条件下转化为单质硫;则发生SO32-+2S2-+6H+=3S↓+3H2O;气体可能为二氧化硫或硫化氢气体;
③亚硫酸钠分解产物中含有硫化钠,根据硫元素的化合价变化可知,另一种产物中硫元素的化合价升高,为硫酸钠;
③由③分析可知Na2SO3固体加热到600℃以上分解产物是Na2SO4和Na2S.
解答:
解:(1)根据假设,亚硫酸钠未分解、完全分解,则第3种情况为亚硫酸钠部分分解;
故答案为:亚硫酸钠部分分解;
(2)关闭分液漏斗的活塞,在装置D中加一定量的水,使整套装置形成密闭系统,用热毛巾捂热装置A中的烧瓶,瓶内气体受热膨胀,体积增大,则会发现D中导管有气泡冒出,冷却后,气体体积缩小,大气压压着水进入导管,在D中导管内形成一段水柱,说明该装置不漏气,即装置的气密性良好;
故答案为:关闭分液漏斗的活塞,在装置D中加一定量的水,用热毛巾捂热装置A中的烧瓶,发现D中导管有气泡冒出,冷却后又发现D中导管形成一段水柱,说明该装置的气密性良好;
②温度为700℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫,烧瓶中有气体冒出,可能为SO2,也可能为硫化氢气体,若为二氧化硫,二氧化硫具有漂白性,则B中品红褪色,若为硫化氢,硫化氢和硫酸铜反应生成硫化铜黑色沉淀,则C中出现黑色沉淀,试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出,沉淀为S、气体为硫化氢,则试样溶液中发生反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;
故答案为:SO32-+2S2-+6H+=3S↓+3H2O,B中品红褪色或C中出现黑色沉淀;
③亚硫酸钠分解产物中含有硫化钠,硫元素的化合价降低,则另一种产物中硫元素的化合价升高,为硫酸钠,要检验硫酸根离子的存在,先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若无明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
故答案为:先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若无明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
④由③分析可知Na2SO3固体加热到600℃以上分解产物是Na2SO4和Na2S,
则反应的方程式为:4Na2SO3
Na2S+3Na2SO4;
故答案为:4Na2SO3
Na2S+3Na2SO4.
故答案为:亚硫酸钠部分分解;
(2)关闭分液漏斗的活塞,在装置D中加一定量的水,使整套装置形成密闭系统,用热毛巾捂热装置A中的烧瓶,瓶内气体受热膨胀,体积增大,则会发现D中导管有气泡冒出,冷却后,气体体积缩小,大气压压着水进入导管,在D中导管内形成一段水柱,说明该装置不漏气,即装置的气密性良好;
故答案为:关闭分液漏斗的活塞,在装置D中加一定量的水,用热毛巾捂热装置A中的烧瓶,发现D中导管有气泡冒出,冷却后又发现D中导管形成一段水柱,说明该装置的气密性良好;
②温度为700℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫,烧瓶中有气体冒出,可能为SO2,也可能为硫化氢气体,若为二氧化硫,二氧化硫具有漂白性,则B中品红褪色,若为硫化氢,硫化氢和硫酸铜反应生成硫化铜黑色沉淀,则C中出现黑色沉淀,试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出,沉淀为S、气体为硫化氢,则试样溶液中发生反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;
故答案为:SO32-+2S2-+6H+=3S↓+3H2O,B中品红褪色或C中出现黑色沉淀;
③亚硫酸钠分解产物中含有硫化钠,硫元素的化合价降低,则另一种产物中硫元素的化合价升高,为硫酸钠,要检验硫酸根离子的存在,先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若无明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
故答案为:先取固体试样溶于水配成溶液,取少量溶液于试管中,先加稀盐酸,若无明显现象,再加氯化钡溶液,若有白色沉淀生成,说明SO42-有存在;
④由③分析可知Na2SO3固体加热到600℃以上分解产物是Na2SO4和Na2S,
则反应的方程式为:4Na2SO3
| ||
故答案为:4Na2SO3
| ||
点评:本题考查性质实验方案的设计,注意实验现象的分析推测、实验结果的研究处理等问题,侧重分析与实验能力的综合考查,题目难度较大.

练习册系列答案
相关题目
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判断有关离子的还原性从强到弱的顺序是( )
| A、Br->Fe2+>I- |
| B、I->Fe2+>Br- |
| C、Br->I->Fe2+ |
| D、Fe2+>I->Br- |
下列化学工业有关设备、原料、反应条件配套的是( )
| A、接触法制硫酸:氧化炉、硫铁矿、V2O5、400℃-500℃ |
| B、联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收二氧化碳 |
| C、合成氨:沸腾炉、焦炭、铁触媒、500℃ |
| D、氨氧化法制硝酸:合成塔、空气、铂铑合金、800℃ |

 时,A发生的反应类型为
时,A发生的反应类型为