题目内容
16.镍镉可充电电池在现代生活中有广泛应用.该电池的电解质溶液为KOH溶液,它们放电时的反应式为:Cd+2NiOOH+2H2O═Cd(OH)2+2Ni(OH)2
则:(1)该电池放电时,负极材料为Cd;
(2)该电池放电时,负极反应式为Cd+2OH--2e-=Cd(OH)2;
(3)该电池充电时,阳极的电极反应式为Ni(OH)2-e-+OH-═NiOOH+H2O.
分析 (1)放电时,Cd失去电子发生氧化反应,作负极;
(2)根镍镉碱性充电电池在放电时,正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,负极反应为:Cd+2OH--2e-=Cd(OH)2;
(3)镍镉碱性电池充电时阳极失去电子发生氧化反应,根据电池总反应可知,NiOOH失去电子发生氧化反应,据此写出电极反应.
解答 解:(1)放电时,Cd失去电子发生氧化反应,作负极,
故答案为:Cd;
(2)根镍镉碱性充电电池在放电时,正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,负极反应为:Cd+2OH--2e-=Cd(OH)2,
故答案为:Cd+2OH--2e-=Cd(OH)2;
(3)根据反应原理可知,镍镉碱性充电电池充电时阳极失去电子发生氧化反应,其电极反应为:Ni(OH)2-e-+OH-═NiOOH+H2O,
故答案为:Ni(OH)2-e-+OH-═NiOOH+H2O.
点评 本题考查了原电池与电解池工作原理等知识,题目难度中等,正确的寻找两电极及书写电极反应式是解题的关键,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
7. 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物完全燃烧需消耗25molO2 | |
| C. | 1mol该有机物最多可以和10molH2发生加成反应 | |
| D. | 该有机物的一氯代产物的同分异构体有12种 |
4.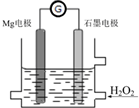 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
11.一定温度下,可逆反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时生成3mol B2 | |
| C. | 容积一定时,容器内气体密度保持不变 | |
| D. | 容器内A2、B2、AB3的物质的量浓度相等 |
1.某甲、乙两种气态烃混合物,其中甲的相对分子质量小于乙,混合气体的密度是相同状况下H2密度的13倍,把标准状况下4.48L该混合气体通入足量的溴水中,溴水增重2.8g,则下列有关叙述错误的是( )
| A. | 甲一定是烷烃 | |
| B. | 乙的物质的量为0.05mol | |
| C. | 符合条件的乙的可能结构有3种(包含顺反异构) | |
| D. | 甲的质量为2.4g |
5.关于常温下pH=12的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水溶液的浓度等于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.01 mol•L-1 | |
| D. | 往等体积的两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小 |
1.下列有关化学用语表示正确的是( )
| A. | 漂白粉有效成分的化学式:Ca(ClO)2 | |
| B. | 亚硫酸的电离方程式:H2SO3═2H++SO32- | |
| C. | NO、NO2都是酸性氧化物 | |
| D. | Na+的结构示意图: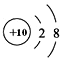 |
 ,反应类型:加聚反应(或聚合反应)
,反应类型:加聚反应(或聚合反应) 反应类型:取代反应
反应类型:取代反应