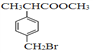
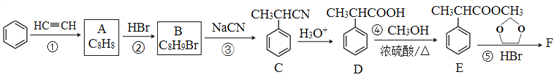
题目内容
【题目】计算:
(1)同温同压下,等质量的SO2气体和CO气体密度之比为________;体积比为________;原子个数比为________。
(2)某混合溶液中只含有下列几种离子:Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为0.2mol/L、0.25mol/L、0.5mol/L、0.25mol/L,则c(Al3+)=________。
(3)在标准状况下,某混合气体密度是2.86gL-1,该混合气体的平均相对分子质量是________;现有质量比为11:7的CO2和CO的混合气体,该混合气体的摩尔质量为________。
【答案】16:7 7:16 21:32 0.1mol/L 64 36g/mol
【解析】
(1)根据ρ=M÷Vm可知,同温同压下等质量的SO2气体和CO气体密度之比等于摩尔质量之比=64g·mol-1:28g·mol-1=16:7;根据V=nVm=![]() Vm可知,同温同压下等质量的SO2和CO的体积之比与摩尔质量呈反比,二者体积之比为28g·mol-1:64g·mol-1=7:16;根据n=m÷M可知,质量相等时其物质的量与摩尔质量呈反比,二者物质的量之比为28g·mol-1:64g·mol-1=7:16,根据N=nNA可知,含有原子数之比为(7×3):(16×2)=21:32,
Vm可知,同温同压下等质量的SO2和CO的体积之比与摩尔质量呈反比,二者体积之比为28g·mol-1:64g·mol-1=7:16;根据n=m÷M可知,质量相等时其物质的量与摩尔质量呈反比,二者物质的量之比为28g·mol-1:64g·mol-1=7:16,根据N=nNA可知,含有原子数之比为(7×3):(16×2)=21:32,
故答案为:16:7;7:16;21:32;
(2)溶液中存在电荷守恒:c(Na+)+2c(Mg2+)+3c(Al3+)=c(Cl-)+2c(SO42-),则c(Al3+)=![]() (0.5+2×0.25-0.2-0.25×2)mol·L-1=0.1mol·L-1,
(0.5+2×0.25-0.2-0.25×2)mol·L-1=0.1mol·L-1,
故答案为:0.1mol·L-1;
(3)在标准状况下,某混合气体密度是 2.86g·L-1,该混合气体的平均摩尔质量为:M=ρVm=22.4L·mol-1×2.86g·L-1=64.064g·mol-1≈64g·mol-1,其平均相对分子质量是64;
现有质量比为 11:7 的 CO2 和 CO 的混合气体,该混合气体的摩尔质量为: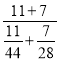 g·mol-1=36g·mol-1,
g·mol-1=36g·mol-1,
故答案为:64;36g·mol-1。