题目内容
9.下列物质属于碱性氧化物的是( )| A. | SiO2 | B. | CaO | C. | CO | D. | NaOH |
分析 大多数金属氧化物为碱性氧化物,且与酸反应生成盐和水时为碱性氧化物,以此来解答.
解答 解:A.SiO2与碱反应生成盐和水,为酸性氧化物,故A不选;
B.CaO与酸反应生成盐和水,为碱性氧化物,故B选;
C.CO为不成盐氧化物,故C不选;
D.NaOH由三种元素组成,不是氧化物,属于碱,故D不选;
故选B.
点评 本题考查物质的分类,为高频考点,把握物质的组成、分类依据及方法为解答的关键,侧重分析与应用能力的考查,注意碱性氧化物一定为金属氧化物、但金属氧化物不一定为碱性氧化物,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
19.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 将Na2O2投入水中 | D. | 将锌粒投入Cu(NO3)2溶液 |
20.下列设计的实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
17.X、Y、Z、W、M五种短周期的主族元素,原子序数依次增大,X、Y两元素的最高正价与最低负价之和均为0,元素Z在周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,这五种元素的原子最外层电子数之和为15,下列说法错误的是( )
| A. | X与Y以1:1的原子个数比形成的化合物有多种 | |
| B. | W的最高价氧化物的水化物与Z的最高价氧化物的水化物之间不反应 | |
| C. | 含有元素W的盐溶液既能显酸性,也能显碱性 | |
| D. | 五种元素原子半径:Z>W>M>Y>X |
4.化学与生活和生产密切相关,下列过程未涉及到化学变化的是( )
| A. | 皮肤被紫外线灼伤 | B. | NaHCO3药片做抗酸药 | ||
| C. | 甘油做护肤保湿剂 | D. | 供能剂MgH2为氢能源汽车提供H2 |
14.下列说法不正确的是( )
| A. | 氯化钠可用于制备纯碱 | |
| B. | 食品袋中常放有生石灰,能起到抗氧化剂的作用 | |
| C. | 大力推广矿物脱硫技术能减少酸雨危害 | |
| D. | 石油裂解、煤的干馏、玉米酿酒、蛋白质变性都属于化学变化 |
1.下列离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2═SO42- | |
| C. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
18.下列说法正确的是( )
| A. | KAl(SO4)2溶液中 c(K+)=2c(SO42-) | |
| B. | 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大 | |
| C. | 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-)=c(Br-) | |
| D. | 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸Ka=1.75×10-5 ) |
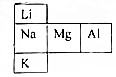 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出: