题目内容
18.回答下列问题(1)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)?N2O4(g),反应达平衡后,N2O4的体积分数为a,在温度不变的条件下,再向该容器加入1molN2O4气体,反应重新达平衡后,N2O4的体积分数为b,则a<b(填“>”“=”“<”,)
(2)已知胆矾溶于水时溶液温度降低.胆矾分解的热化学方程式为CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H=+Q1 mol•L-1.室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2 kJ,则Q1>Q2(填写>,=或<)
分析 (1)据压强增大时,平衡向气体体积减小的方向移动分析;
(2)胆矾溶于水时可分为两步,一是胆矾分解成无水硫酸铜,二是无水硫酸铜溶解,然后结合盖斯定律来解答.
解答 解:(1)体积不变,温度不变的条件下,再向该容器加入1molN2O4,由于生成物浓度增大,平衡逆向移动,但逆向移动时压强增大,所以,移动的结果不如原平衡,所以,N2O4的体积分数比原平衡大,故答案为:<;
(2)胆矾溶于水时溶液温度降低,可知其为吸热过程,△H>0,
1mol胆矾分解生成1molCuSO4(s)时,CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H=+Q1 KJ•mol-1
1molCuSO4(s)溶解时放热Q2 kJ
可得如下图所示关系,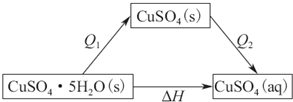
根据盖斯定律,则有△H=Q1+(-Q2)>0,则Q1>Q2,
故答案为:>.
点评 本题考查了热化学方程式书写和计算,影响化学平衡的因素分析判断,解答此类习题的关键是,读懂题意,正确列出图示关系,掌握基础是关键,题目难等中等.

练习册系列答案
相关题目
9.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol•L-1,现有该温度下的四份溶液:①pH=2的CH3COOH;②0.01mol•L-1的HCl;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 若将②与④按照10:1的体积比混合,混合溶液的pH<7 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:④>③>①>② |
6.标准状况下,将a L SO2和Cl2组成的混合气体通入100mL 0.1mol•L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65g.则下列关于该过程的推断不正确的是( )
| A. | 所得沉淀为0.05 mol的BaSO4 | B. | 混合气体中SO2的体积为0.448L | ||
| C. | a L混合气体的物质的量为0.04mol | D. | a的取值范围为0.672<a<0.896 |
13.同物质的量浓度的KCl、CaCl2、AlCl3三种溶液的体积比为3:2:1,这三种溶液中Cl-的物质的量之比是( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:4:3 | D. | 2:3:1 |
7.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | 单位时间内生成amolX,同时生成3amolY | |
| B. | X、Y、Z的分子数之比为1:3:2 | |
| C. | Z的生成速率与Z的分解速率相等 | |
| D. | 单位时间生成3amolY,同时生成3amolZ |
8.下列物质中既可通过化合反应生成,又可通过复分解反应生成的是( )
| A. | S03 | B. | HN03 | C. | CuS | D. | Al2S3 |

 .
.

 .反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
.反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.