题目内容
15.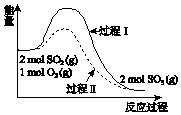 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应能量变化如图所示.下列说法中,不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应能量变化如图所示.下列说法中,不正确的是( )| A. | a<0 | |
| B. | 过程II可能使用了催化剂 | |
| C. | 使用催化剂可以提高SO2的平衡转化率 | |
| D. | 反应物断键吸收能量之和小于生成物成键释放能量之和 |
分析 由图象可知,反应物总能量大于生成物总能量,为放热反应,过程II活化能较低,可加入催化剂,以此解答该题.
解答 解:A.反应物总能量大于生成物总能量,为放热反应,则a<0,故A正确;
B.过程II活化能较低,可加入催化剂,故B正确;
C.加入催化剂,平衡不移动,故C错误;
D.为放热反应,则反应物断键吸收能量之和小于生成物成键释放能量之和,故D正确.
故选C.
点评 本题考查反应过程的能量变化,为高频考点,侧重于学生的分析能力的考查,难度不大,注意活化能与反应热的关系,题目有利于培养学生良好的科学素养.

练习册系列答案
相关题目
16.生活中常见的荧光棒的发光原理可用下式表示: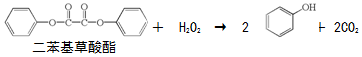
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光.下列说法正确的是( )
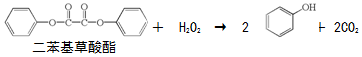
上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光.下列说法正确的是( )
| A. | 上述反应是酯的水解反应 | |
| B. | 荧光棒发光过程涉及化学能到光能的转化 | |
| C. | 二苯基草酸酯苯环上的一氯代物共有4种 | |
| D. | 二苯基草酸酯与草酸( 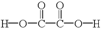 )互为同系物 )互为同系物 |
6.下列说法中正确的是( )
| A. | 化学只研究自然界中存在的物质 | |
| B. | 化学的特征是认识分子和制造分子 | |
| C. | 通过化学方法可以制造出使人长生不老的“仙丹” | |
| D. | 化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴 |
20.青蒿酸是合成青蒿素的原料,可以由香草醛合成: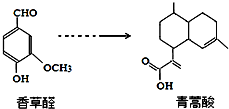 下列有关叙述正确的是( )
下列有关叙述正确的是( )
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 香草醛的分子式是C8H10O3 | |
| B. | 香草醛能与NaHCO3溶液反应 | |
| C. | 两种物质均可与溴的四氯化碳溶液发生加成反应 | |
| D. | 可用FeCl3溶液检验青蒿酸中是否含香草醛 |
7.下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是( )
| A. | 硝酸银溶液与盐酸反应生成氯化银 | |
| B. | 镁条与氯化铵溶液反应生成氢气 | |
| C. | 盐酸与碳酸钙反生成二氧化碳 | |
| D. | 硫酸铝溶液和小苏打溶液反应生成二氧化碳 |
5.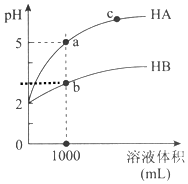 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)=10-3mol/L.
(2)由图可判断:HA的酸性>(填“>”或“<”)HB的酸性.
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明
.
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示:(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)=10-3mol/L.
(2)由图可判断:HA的酸性>(填“>”或“<”)HB的酸性.
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明
| 物质 | 稀释中变化 | 稀释中n(H+)变化 | 稀释中c(H+)减小程度 |
| HA | HA=H++A-不移动 | 不变 | 大 |
| HB | HB?H++B- 正向移动 | 增加 | 小 |
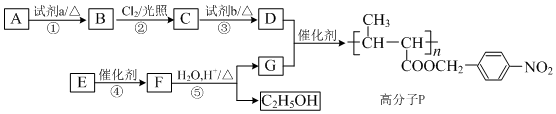
 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$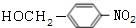 +NaCl.
+NaCl.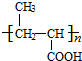 .
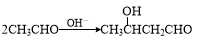
.
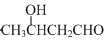 .
.
 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.