题目内容
19.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 0.5molO3与11.2LO2所含的分子数一定相等 |
分析 A.每个NO2和CO2分子均含有2个O原子,故二者混合气体中含有O原子数目为分子总数的2倍;
B.乙烯和环丁烷的最简式为CH2,根据最简式计算出混合物中含有碳原子数目;
C.NO2和N2O4分子的最简式为NO2,根据最简式计算出混合气体中含有的原子数;
D.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.每个NO2和CO2分子均含有2个O原子,故分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA,故A正确;
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有28g最简式CH2,含有最简式CH2的物质的量为:$\frac{28g}{14g/mol}$=2mol,含有碳原子的物质的量为2mol,含有碳原子数为2NA,故B正确;
C.92g的NO2和N2O4混合气体中含有92个最简式NO2,含有最简式NO2的物质的量为:$\frac{92g}{46g/mol}$=2mol,则含有原子的总物质的量为0.6mol,含有的原子数为6NA,故C正确;
D.不是标准状况下,不能使用标准状况下的气体摩尔体积计算11.2LO2的物质的量,故D错误;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意熟练掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
9.下列各组物质中属于同分异构体的是( )
| A. |  和 和 | B. | CH3CH2OH 和 CH3 CH2-O-CH2CH3 | ||
| C. |  和 和 | D. |  和 和 |
10.电解质在溶液中的行为是化学研究的重要内容.下列有关溶液的叙述正确的是( )
| A. | 常温下 pH为5的盐酸溶液稀释 1000倍后,pH 等于8 | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为0.1 mol/L的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 等浓度的 CH3COOH与 KOH任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
7.下列说法符合汤姆孙原子结构模型的观点是( )
①任何原子都是电中性的;
②原子像带正电的海洋,电子漂在正电荷的海洋中;
③原子是由带正电的物质和电子构成的;
④阴极射线产生的原因是电子很小,在原子受打击时电子就容易跑出去.
①任何原子都是电中性的;
②原子像带正电的海洋,电子漂在正电荷的海洋中;
③原子是由带正电的物质和电子构成的;
④阴极射线产生的原因是电子很小,在原子受打击时电子就容易跑出去.
| A. | ①②④ | B. | ① | C. | ①②③ | D. | ①②③④ |
4.在氢氧化钾溶液中,已知钾离子与水分子的物质的量之比为a:b,溶液的密度为ρg/cm3,则溶液的浓度为( )
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |
11.下列醇不能发生催化氧化的是( )
| A. | CH3OH | B. | CH3CH2CH2OH | C. | CH3CH(OH)CH3 | D. | (CH3)2CH(CH3)2COH |
8.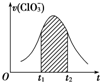 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 图中阴影部分“面积”可以表示t1-t2时间为c(Cl-)增加 |