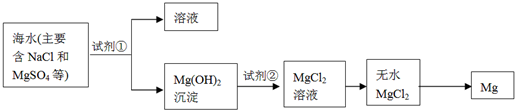
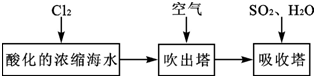
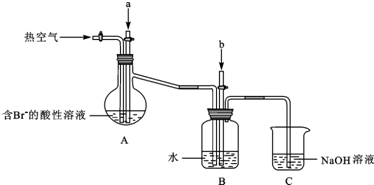
题目内容
17.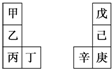 甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )
甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成离子化合物 |
分析 戊的一种单质(金刚石)是自然界硬度最大的物质,则戊为C元素;甲与戊的原子序数相差3,则甲的原子序数为6-3=3,甲为Li元素;由元素在周期表中的相对位置图可知,乙为Na、丙为K、丁为Ca;丁与辛属同周期元素,由第ⅣA族元素可知,己为Si、庚为Ge、辛为Ga,然后结合元素周期律及元素化合物知识来解答.
解答 解:戊的一种单质(金刚石)是自然界硬度最大的物质,则戊为C,甲与戊的原子序数相差3,则甲的原子序数为6-3=3,即甲为Li,由元素在周期表中的相对位置图可知,乙为Na,丙为K,丁为Ca;丁与辛属同周期元素,由第ⅣA族元素可知,己为Si,庚为Ge,辛为Ga,
A.同主族,从上到下金属性增强;同周期,从左向右金属性减弱,则金属性:甲<乙<丁,故A错误;
B.电子层越多,半价越大;同主族从上到下原子半径增大,则原子半径大小为:辛>己>戊,故B正确;
C.原子序数等于核外电子数,丙(原子序数为19)与庚(原子序数为32)的原子核外电子数相差32-19=13,故C正确;
D.钠在空气中燃烧生成过氧化钠,过氧化钠中含有离子键和共价键,为离子化合物,故D正确;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,把握金刚石的硬度及甲与戊的原子序数关系推断各元素为解答的关键,选项A中Ca的金属性比Na强为解答的易错点,注意金属活动性顺序表的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 消除制硝酸工业尾气中的氮氧化物的污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| B. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| C. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
5. 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
12.下列关于硅及其化合物的说法正确的是( )
| A. | 硅是光导纤维的主要成分 | |
| B. | 硅钨酸H4SiW12O40中W的化合价为+6 | |
| C. | 二氧化硅与水反应制得的硅酸溶胶有丁达尔效应 | |
| D. | 硅是非金属元素,合金材料中不可能含有硅 |
2.下列物质中,含非极性共价键的离子化合物的是( )
| A. | MgCl2 | B. | Na2O2 | C. | NH3 | D. | NH4NO3 |
7.过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2?CH3COOOH+H2O,下列有关说法正确的是( )
| A. | 降低温度可加快该反应速率 | |
| B. | 加入合适的催化剂可提高H2O2转化率 | |
| C. | 达到平衡时,v(正)=v(逆)=0 | |
| D. | 达到平衡时,v正(CH3COOH)=v逆(H2O2) |

 个该原子
个该原子