题目内容
15.“含氟牙膏”中的氟应理解为( )| A. | 单质 | B. | 元素 | C. | 原子 | D. | 分子 |
分析 物质组成中涉及到的含氟等说法,都是关注物质的组成元素,而与该元素具体的存在形态无关,所以都是指元素.
解答 解:“含氟牙膏”等商品,这些商品中所强调的氟,都是说明这些物质的存在,而不关注以什么形式存在,或者便于说明如何存在,所以就用宏观的元素种类来说明,因此理解为元素.
故选B.
点评 本题考查物质的组成知识,难度不大,主要考查元素与微观粒子及物质的区别,加深对元素概念的理解是正确解答此类试题的关键.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.某温度下,反应H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=$\frac{9}{4}$.该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
| 起始量 | 甲 | 乙 | 丙 |
| H2 (mol) | 1 | 2 | 2 |
| CO2(mol) | 1 | 1 | 2 |
| A. | 反应开始时,甲中的反应速率最慢,丙中的反应速率最快 | |
| B. | 平衡时,甲和丙中CO2的转化率相等,均是60% | |
| C. | 平衡时,乙中H2的转化率大于60% | |
| D. | 平衡时,丙中c(H2)是0.08 mol•L-1 |
3.下列有关溶液组成的描述合理的是( )
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| B. | 在氢氧化铁胶体中能大量存在:H+、K+、S2-、Br- | |
| C. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中一定能大量共存:Na+、[Al(OH)4]-、S2-、CO32- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
10.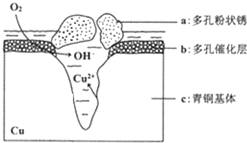 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
20.下列实验装置图,其中关于用途的描述,不正确的是( )

| A. | 装置甲:用于制取并收集乙酸乙酯 | |
| B. | 装置乙:用于分离两种沸点不同的两种物质 | |
| C. | 装置丙:收集二氧化碳,从a口进气b口排气 | |
| D. | 装置丁:可用来制取氨气 |
7.若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为( )
| A. | $\frac{36.5a}{22.4(a+1)d}$ | B. | $\frac{1000ad}{36.5a+22.4}$ | ||
| C. | $\frac{ad}{36.5a+22400}$ | D. | $\frac{1000ad}{36.5a+22400}$ |
4.次磷酸盐可用于化学镀铜,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸钙和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁粉和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向澄清石灰水中通入少量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |