题目内容
NaHCO3和KHCO3的混合物18.4g与100mL盐酸恰好完全反应,得到标准状况下CO2的体积为4.48L.求
(1)混合物中NaHCO3的质量是多少?
(2)HCl的物质的量浓度是多少?
解:NaHCO3和KHCO3与盐酸都发生反应:HCO3-+H+=CO2↑+H2O,令混合物中NaHCO3和KHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的体积列方程,则:
 ,解得x=0.1,y=0.1
,解得x=0.1,y=0.1
(1)故混合物中NaHCO3的质量=0.1mol×84g/mol=8.4g,
答:混合物中碳酸氢钠的质量为8.4g.
(2)由方程式可知n(HCl)=n(CO2)=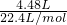 =0.2mol,
=0.2mol,
故盐酸的物质的量浓度=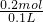 =2mol/L,
=2mol/L,
答:该盐酸的浓度为2mol/L.
分析:NaHCO3和KHCO3与盐酸都发生反应:HCO3-+H+=CO2↑+H2O,令混合物中NaHCO3和KHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的体积列方程计算x、y的值,
(1)根据m=nM计算混合物中NaHCO3的质量;
(2)由方程式可知n(HCl)=n(CO2),再根据c= 计算盐酸的物质的量浓度.
计算盐酸的物质的量浓度.
点评:本题考查混合物的计算、根据方程式的计算等,题目难度不大,注意利用离子方程式的利用.
 ,解得x=0.1,y=0.1
,解得x=0.1,y=0.1(1)故混合物中NaHCO3的质量=0.1mol×84g/mol=8.4g,
答:混合物中碳酸氢钠的质量为8.4g.
(2)由方程式可知n(HCl)=n(CO2)=
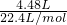 =0.2mol,
=0.2mol,故盐酸的物质的量浓度=
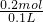 =2mol/L,
=2mol/L,答:该盐酸的浓度为2mol/L.
分析:NaHCO3和KHCO3与盐酸都发生反应:HCO3-+H+=CO2↑+H2O,令混合物中NaHCO3和KHCO3的物质的量分别为xmol、ymol,根据二者质量之和与二氧化碳的体积列方程计算x、y的值,
(1)根据m=nM计算混合物中NaHCO3的质量;
(2)由方程式可知n(HCl)=n(CO2),再根据c=
 计算盐酸的物质的量浓度.
计算盐酸的物质的量浓度.点评:本题考查混合物的计算、根据方程式的计算等,题目难度不大,注意利用离子方程式的利用.

练习册系列答案
相关题目
某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理不正确的是( )
|
| 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 ( )
|
某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):
分析表中数据,下列说法不正确的是( )
| 实验编号 | ① | ② | ③ |
| 盐酸体积 | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 16.56g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、由①可以计算出盐酸的物质的量浓度 |
| B、由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全 |
| C、由①、②可知:①中的固体不足而完全反应 |
| D、由①可以计算出混合物的NaHCO3的质量分数 |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
下列分析推理中不正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、盐酸的物质的量浓度为3.0mol?L-1 |
| B、加入混合物9.2g时盐酸过量 |
| C、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| D、该混合物中NaHCO3和KHCO3的物质的量之比为1:1 |
 有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.