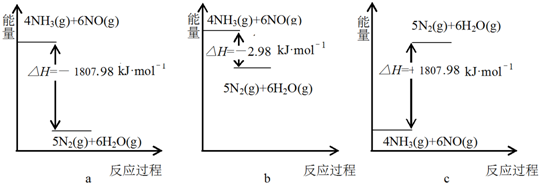
题目内容
19.用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )| A. | 加热 | B. | 改用98%的浓硫酸 | ||
| C. | 改用锌粒 | D. | 滴加少量CuSO4溶液 |
分析 增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.
解答 解:A.温度升高,活化分子的百分数增大,反应速率增大,故A不选;
B.改用98%的浓硫酸,锌在室温下与浓硫酸反应生成二氧化硫气体,不能加快生成氢气的反应速率,故B选;
C.改用锌粒,固体表面积增大,反应速率增大,故C不选;
D.锌置换出铜,形成原电池反应,加快反应速率,故D不选.
故选B.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与锌反应的性质,为易错点.

练习册系列答案
相关题目
10.离子方程式2Ba2++3HCO3-+3OH-→2BaCO3↓+CO32-+3H2O可以表示( )
| A. | Ba(HCO3)2与NaOH溶液反应 | B. | NaHCO3与Ba(OH)2溶液反应 | ||
| C. | Ba(HCO3)2与Ba(OH)2溶液反应 | D. | NH4HCO3与Ba(OH)2溶液反应 |
14.25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性.下列判断一定正确的是( )
| A. | HA酸溶液的pH值一定等于1 | |
| B. | HA酸溶液的物质的量浓度一定等于0.1mol/L | |
| C. | 中和后溶液中M+离子浓度一定等于A-离子浓度 | |
| D. | 中和后生成的盐MA一定没有发生水解 |
11.将一小段铝片放入盛有 2mol/L的NaOH溶液中.ⅰ.开始时,没有明显现象;ⅱ.过一会儿,有大量气泡产生;ⅲ.把点燃的木条放在试管口,有爆鸣声.下列说法不正确的是( )
| A. | 现象ⅰ、ⅱ说明NaOH溶液能溶解Al2O3 | |
| B. | 现象ⅱ、ⅲ是因为发生了反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 现象ⅰ、ⅱ,可推测家用铝制餐具不宜长时间盛放碱性食物 | |
| D. | 上述实验说明活泼金属都具有类似的性质 |
8.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 二氧化硫可广泛用于食品的漂白 | |
| B. | 从海水提取物质都必须通过化学反应才能实现 | |
| C. | 葡萄糖可用于补钙药物的合成 | |
| D. | “地沟油”禁止食用,也不能用来制肥皂 |
 (I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.
(I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.