题目内容
下图中A~H均为中学化学常见物质,它们之间有如下转化关系.实验室中常用A与B的反应原理制取气体E,E能使湿润的红色石蕊试纸变蓝,无水的D常用做干燥剂;C是常见的金属单质,C、H均既能与盐酸反应又能与烧碱反应.
(1)A的电子式为 .
(2)H的化学式为 .
(3)反应①的化学方程式为 .
(4)反应③的离子方程式为 .
【答案】分析:C、H均既能与盐酸反应又能与烧碱反应,H电解生成C和氧气,C是金属单质,能和盐酸、氢氧化钠溶液反应的金属是
Al,则H是Al2O3,白色沉淀加热生成氧化铝和水,所以白色沉淀是氢氧化铝;盐酸和铝反应生成氯化铝和氢气,F和E反应生成氢氧化铝和A,所以F是氯化铝,G是氢气;E能使湿润的红色石蕊试纸变蓝,说明E呈碱性,则为氨气;实验室常用氯化铵和氢氧化钙反应制取氨气,生成氯化钙、氨气和水,所以D是氯化钙,氨气、水和氯化铝反应生成氢氧化铝和氯化铵,所以A是氯化铵,则B是氢氧化钙.
解答:解:C、H均既能与盐酸反应又能与烧碱反应,H电解生成C和氧气,C是金属单质,能和盐酸、氢氧化钠溶液反应的金属是
Al,则H是Al2O3,白色沉淀加热生成氧化铝和水,所以白色沉淀是氢氧化铝;盐酸和铝反应生成氯化铝和氢气,F和E反应生成氢氧化铝和A,所以F是氯化铝,G是氢气;E能使湿润的红色石蕊试纸变蓝,说明E呈碱性,则为氨气;实验室常用氯化铵和氢氧化钙反应制取氨气,生成氯化钙、氨气和水,所以D是氯化钙,氨气、水和氯化铝反应生成氢氧化铝和氯化铵,所以A是氯化铵,则B是氢氧化钙.
(1)通过以上分析知,A是氯化铵,氯化铵是离子化合物,存在离子键、共价键和配位键,电子式为 ;
;
故答案为: ;
;
(2)通过以上分析知,H是氧化铝,化学式为Al2O3;
故答案为:Al2O3;
(3)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,
反应方程式为 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)氨气、水和氯化铝反应生成氯化铵和氢氧化铝,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+.
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,能正确判断元素化合物是解本题的关键,注意氢氧化铝能溶于强碱不能溶于弱碱.
Al,则H是Al2O3,白色沉淀加热生成氧化铝和水,所以白色沉淀是氢氧化铝;盐酸和铝反应生成氯化铝和氢气,F和E反应生成氢氧化铝和A,所以F是氯化铝,G是氢气;E能使湿润的红色石蕊试纸变蓝,说明E呈碱性,则为氨气;实验室常用氯化铵和氢氧化钙反应制取氨气,生成氯化钙、氨气和水,所以D是氯化钙,氨气、水和氯化铝反应生成氢氧化铝和氯化铵,所以A是氯化铵,则B是氢氧化钙.
解答:解:C、H均既能与盐酸反应又能与烧碱反应,H电解生成C和氧气,C是金属单质,能和盐酸、氢氧化钠溶液反应的金属是
Al,则H是Al2O3,白色沉淀加热生成氧化铝和水,所以白色沉淀是氢氧化铝;盐酸和铝反应生成氯化铝和氢气,F和E反应生成氢氧化铝和A,所以F是氯化铝,G是氢气;E能使湿润的红色石蕊试纸变蓝,说明E呈碱性,则为氨气;实验室常用氯化铵和氢氧化钙反应制取氨气,生成氯化钙、氨气和水,所以D是氯化钙,氨气、水和氯化铝反应生成氢氧化铝和氯化铵,所以A是氯化铵,则B是氢氧化钙.
(1)通过以上分析知,A是氯化铵,氯化铵是离子化合物,存在离子键、共价键和配位键,电子式为
 ;
;故答案为:
 ;
;(2)通过以上分析知,H是氧化铝,化学式为Al2O3;
故答案为:Al2O3;
(3)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,
反应方程式为 2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2
 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;(4)氨气、水和氯化铝反应生成氯化铵和氢氧化铝,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+;
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+.
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,能正确判断元素化合物是解本题的关键,注意氢氧化铝能溶于强碱不能溶于弱碱.

练习册系列答案
相关题目

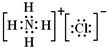

 (1)E是 ,F是 (填化学式)。
(1)E是 ,F是 (填化学式)。