题目内容
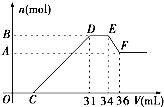
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是( )

A.合金与硝酸反应时硝酸过量
B.合金中铝的物质的量为0.008 mol
C.合金中金属的物质的量共为0.032 mol
D.无法求出C点的值
【答案】
D
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①0→C:H++OH-=H2O;②C→31:R3++3OH-=R(OH)3↓(R代表Fe或Al);③31→34:NH4++ OH-=NH3•H2O;④34→36:Al(OH)3+ OH-=AlO2-+ 2H2O。由④知n[Al(OH)3]=0.002L×4mol·L-1=0.008mol=n(Al),此值也是B与A的差值。由③知,n(NH4NO3)=0.003L×4mol·L-1=0.012mol,根据反应中得失电子相等的原则得:3n(R3+)="0.012×8=0.096" mol,则n(R3+)=0.032mol=n(合金),故混合物中n(Al):n(Fe)=1:3。0→31mL中,用于沉淀金属离子的OH-有0.032 mol×3="0.096" mol,故C点:(0.031L×4 mol·L-1-0.096 mol)÷4 mol·L-1=0.007L,即7mL

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )| A、合金与硝酸反应时硝酸过量 | B、合金中铝的物质的量为0.008mol | C、合金中金属的物质的量共为0.032mol | D、无法求出C点的值 |

 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示: