题目内容
4.下列各组微粒属于等电子体的是( )| A. | CO和CO2 | B. | NO和NO2 | C. | CH4和NH3 | D. | CO2和N2O |
分析 原子数总数相同、价电子总数相同的微粒,互称为等电子体.
解答 解:A.CO中含有2个原子,CO2中含有3个原子,价电子总数分别为10、16,所以不是等电子体,故A错误;
B.NO中含有2个原子,NO2中含有3个原子,价电子总数分别为11、17,所以不是等电子体,故B错误;
C.CH4中含有5个原子,NH3中含有4个原子,价电子总数分别为8、8,所以不是等电子体,故C错误;
D.CO2和N2O都含有3个原子,其价电子数都是16,所以是等电子体,故D正确.
故选D.
点评 本题考查了等电子体的判断,根据等电子体的概念来分析解答即可,难度不大.

练习册系列答案
相关题目
6.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、Na+、HCO3-、SO42- | B. | Ba2+、NO3-、SO42-、K+ | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Mg2+、Fe3+、Cl-、OH- |
12.下列气体主要成分不是甲烷的是( )
| A. | 天然气 | B. | 沼气 | C. | 煤矿坑道气 | D. | 液化石油气 |
19. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO${\;}_{4}^{2-}$向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲、乙两烧杯中Cu片的质量均不变.
 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO${\;}_{4}^{2-}$向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲、乙两烧杯中Cu片的质量均不变.
| A. | ①②③ | B. | ③⑤⑦ | C. | ④⑤⑥ | D. | ②③④⑤⑦ |
9.水是最常用的溶剂,许多化学反应都需要在水溶液中进行.请仔细分析并回答下列各题.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
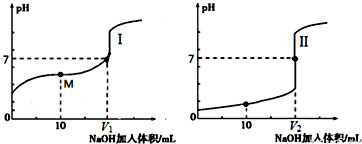
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:

①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为酚酞,符合其滴定曲线的是I(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中v1和v2大小的比较:v1<v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
①请结合化学用语和必要的文字解释步骤2 现象出现的原因:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,Fe3+与SCN-结合生成Fe(SCN)3从而显红色.
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀,溶液红色变浅.
③写出步骤4 中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
16.下列关于糖类、油脂和蛋白质的性质说法正确的是( )
| A. | 糖类物质中含C、H、O元素,都有甜味 | |
| B. | 油脂是高分子化合物,热值较大 | |
| C. | 在蛋白质溶液中加入CuSO4溶液后有物质析出,加水后该物质溶解 | |
| D. | 向淀粉溶液中加入碘水,溶液变蓝 |
14.下列实验能达到预期目的是( )
| A. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| B. | 用食醋和澄清石灰水验证蛋壳中含碳酸盐 | |
| C. | 直接往淀粉水解液中滴入银氨溶液可产生银镜 | |
| D. | 用分液漏斗分离溴和苯 |