题目内容
海洋是一个巨大的宝藏,期待着人们的开发和利用,下列有关海水综合利用的说法正确的是
A.从海水中提取溴单质只有物理变化发生
B.从海水制海盐主要是通过化学变化完成
C.电解熔融的氯化镁可制备镁和氯气
D.电解氯化钠溶液可以制得钠和氯气
C
【解析】
试题分析:溴在海水中以化合态形式存在,海水中提取溴单质一定要发生化学反应,A错;海水制海盐主要是通过蒸发得到,蒸发是物理变化,B错;电解氯化钠溶液得到氢氧化钠、氯气和氢气,D错。
考点:物质的制取。

 名校课堂系列答案
名校课堂系列答案(12分)实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4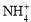 + 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
+ 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+ 相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
滴定次数 | 待测液的体积(mL) | 标准溶液的体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
根据上述实验步骤填空:
(1)滴定操作时,眼睛应观察
(2)滴定终点的判断方法是
(3)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(4)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分
数 (填“偏大”、“偏小”或“无影响”)
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,
还有 (填仪器名称)
(6)该样品中氮的质量分数为
 2Cu+O2↑+4H+
2Cu+O2↑+4H+

 4CO2(g)+5H2O(l);?H =-2878 kJ?mol-1
4CO2(g)+5H2O(l);?H =-2878 kJ?mol-1
