题目内容
16.设NA为阿佛加德罗常数的数值,下列说法中,正确的是( )| A. | 22.4L Cl2完全溶液氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,18g D2O中所含电子的数目为10NA | |
| C. | 标准状况下,2.24L NH3中含有的共价键数目为0.3NA | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
分析 A、气体体积,温度压强不知不能计算物质的量;
B.物质的量n=$\frac{m}{M}$,D2O中含10个电子计算;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol.
解答 解:A、气体体积,温度压强不知不能计算物质的量,故A错误;
B.物质的量n=$\frac{m}{M}$=$\frac{18g}{20g/mol}$=0.9mol,0.9molD2O中含电子数=0.9mol×10×NA=9NA,故B错误;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数=0.3NA,故C正确;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol,22.4 L NO2和N2O4的混合气体中含有氧原子不是NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的体积应用分析,氧化还原反应电子转移的计算,掌握基础是关键,题目难度不大.

练习册系列答案
相关题目
12.下列反应的离子方程式书写正确的是( )
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
4.苄基(C6H5CH2-)、-OH、-CHO、-COOH四种基团,它们之间两两组合,所形成的有机物有( )
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
11. 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.下列有关溶液的说法正确的是( )
| A. | 将质量分数为40%(密度为1.43g•cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% | |
| B. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 | |
| D. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
8.科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )
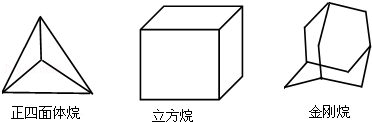

| A. | 2种 4种 8种 | B. | 2种 4种 6种 | C. | 1种 3种 6种 | D. | 1种 3种 8种 |
5.下列各物质中,能发生加成反应的是( )
| A. | 天然气 | B. | 苯 | C. | 沼气 | D. | 瓦斯 |
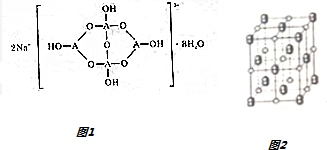

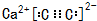 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01) ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为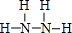 .
.