题目内容
18.25℃时,pH=5的盐酸和pH=5的醋酸,以体积比1:2混合后,溶液的pH是( )| A. | 5 | B. | 5.3 | C. | 4 | D. | 无法确定 |
分析 pH=5的盐酸和pH=5的醋酸,混合后溶液中氢离子浓度不变,据此分析.
解答 解:25℃时,pH=5的盐酸和pH=5的醋酸,以体积比1:2混合后,溶液中氢离子浓度不变,所以溶液的pH不变,即pH=5,
故选A.
点评 本题考查了溶液的pH计算,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+═Fe2++2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
6.香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
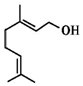

| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H20O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
13. 某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl溶液是电解质 | |
| B. | 电解质在电流的作用下才发生电离 | |
| C. | NaCl溶液中的水电离出大量的离子 | |
| D. | NaCl在水溶液中存在自由移动的离子是溶液能导电的原因 |
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol NaHCO3晶体中含有NA个CO32- | |
| B. | 标准状况下,11.2L的18O2中所含的中子数为8NA | |
| C. | 1mol Fe与足量的稀HNO3反应,转移电子数目为3NA | |
| D. | 标准状况下,22.4L苯中含有碳氢键数目为6NA |
10. 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| A | Cu | FeCl3溶液 | CuCl2溶液 | Fe |
| B | H2O | Fe | H2 | O2 |
| C | CH3CH2OH | O2 | CH3CHO | H2 |
| D | SiO2 | Na2CO3 | Si | O2 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | 下列物质的熔沸点由大到小排列:晶体硅>碳化硅>金刚石 | |
| D. | 黄色晶体碳化铝,熔点2200℃,熔融态不导电,是原子晶体 |
8.下列有关说法正确的是( )
| A. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
