题目内容
沉淀物并非绝对不溶,其在水及各种不同溶液中的溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.如图是AgCl在NaCl、AgNO3溶液中的溶解情况.
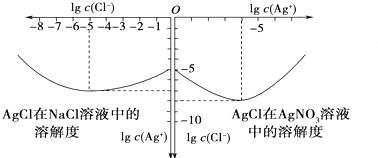
由以上信息可知:
①AgCl的溶度积常数的表达式为 ,由图知AgCl的溶度积常数为 .
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
= .[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10].

由以上信息可知:
①AgCl的溶度积常数的表达式为
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
| c(Br-) |
| c(Cl-) |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:①AgCl的溶度积常数Ksp=c(Ag+)?c(Cl-),结合图中数据计算;
②当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中
=
,依此计算.
②当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中
| c(Br-) |
| c(Cl-) |
| Ksp(AgBr) |
| Ksp(AgCl) |
解答:
解:①AgCl的溶度积常数表达式为:Ksp=c(Ag+)?c(Cl-),当c(Ag+)=10-5mol/L时,c(Cl-)=10-7mol/L,所以AgCl的溶度积常数Ksp=c(Ag+)?c(Cl-)=10-5mol/L?10-7mol/L=10-12(mol/L)2,
故答案为:Ksp=c(Ag+)?c(Cl-);10-12(mol/L)2;
②当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
,c(Cl-)=
,
则
=
=
=2.7×10-3;
故答案为:2.7×10-3.
故答案为:Ksp=c(Ag+)?c(Cl-);10-12(mol/L)2;
②当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
| Ksp(AgBr) |
| c(Ag+) |
| Ksp(AgCl) |
| c(Ag+) |
则
| c(Br-) |
| c(Cl-) |
| Ksp(AgBr) |
| Ksp(AgCl) |
| 5.4×10-13 |
| 2.0×10-10 |
故答案为:2.7×10-3.
点评:本题考查了溶液中离子浓度的计算,注意对Ksp的理解和应用,题目难度较小.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
| C、常温常压下,11.2LN2中含有的分子数为0.5NA |
| D、1L 0.5mol?L-1Na2SO4溶液中含有的钠离子数为NA |
化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A、无机非金属材料可能含有金属元素;人工合成尿素彻底推翻了“生命力论”,使得有机化学得到迅猛发展 |
| B、元素分析仪不仅可以检验C、H、O、N、S等非金属元素,还可以检验Cr、Mn等金属元素 |
| C、改变金属组成和结构的电化学方法可以较好的防治硫酸型酸雨对金属的腐蚀 |
| D、在化学反应过程中,原子核一定不发生变化,但最外层电子数不一定改变 |
下列说法正确的是( )
| A、常温下将pH=3的酸HR溶液与pH=11的NaOH溶液等体积混合,若测得pH≠7,则混合溶液的pH>7 |
| B、在0.1mol/L的Na2S溶液中存在:c(OH-)=c(HS-)+c(H2S)+c(H+) |
| C、向Na2CO3粉末中滴加硼酸溶液,有CO2产生 |
| D、自然界各种原生铜的硫化物经氧化、淋滤作用后变为CuSO4溶液,遇到深层的闪锌矿(ZnS)和方铅矿(PbS)可转变为铜蓝(CuS),说明CuS的溶度积小于ZnS、PbS |
下列说法中不正确的是( )
| A、Ksp只与难溶电解质本身的性质和温度有关 |
| B、在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数 |
| C、在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大 |
| D、由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀 |
 甲醇来源丰富、价格低廉、运输贮存方便,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,有着重要的用途和应用前景.